وسايل آزمايشگاهي وكاربردآنها
نام | کاربرد | تصویر |
| از بشر استفادههای متنوعی میشود از جمله برای نگهداری و حمل و حرارت دادن مایعات و محلولها.
|  |
بطری | بطری برای نگهداری و حفظ مواد جامد و مایع استفاده میشود. |  |
آبفشان یک بطری پلاستیکی مجهز به یک لوله است که به وسیله آن لوله می توان محتوای بطری را به نقطه مشخصی پاشید. |  | |
| چراغ بونزن برای حرارت دادن مواد استفاده میشود و با گاز بوتان کار میکند. |  |
|
|  |
| بورت برای اندازه گیری دقیق مایعات و مخصوصاً در تیتراسیون کاربرد دارد. برای استقرار بورت از پایه بورت استفاده میشود
|  |
بوته چینی برای حرارت دادن مقادیر کمی از مواد و رساندن آن به درجه حرارت خیلی بالا استفاده میشود. |  | |
ارلن مایر (یا فلاسکِ ارلن مایر)
| ارلن مایر برای نگهداری، مخلوط کردن محلولها و حرارت دادن مواد به کار میرود. تخت بودنِ کف آن موجب میشود که مواد به آسانی به طور اتفاقی از آن بیرون نریزند و همچنین موجب میشود که گرم کردن مواد در آن به راحتی صورت گیرد. |  |
ظرف تبخیر | همانطور که از اسم آن معلوم است برای حرارت دادن و بخار کردن مایعات کاربرد دارد. |  |
بالنها در شکل های مختلف و برای استفادههای ساخته میشوند. پر کاربردترین بالن ها "بالن ته صاف" و بالن "ته گرد" است. از بالن برای حرارت دادن مایعاتی استفاده میشود که لازم است همه ان به طور یکنواخت گرم شود. بیشترین کاربرد بالن شیشهای در تقطیر مواد است. بالن حجمی هنگامی استفاده میشود که حجم مشخصی از مایع را در آزمایشی مورد استفاده فرار میدهیم. |  | |
| برای انتقال مایعات |  |
قیف بوخنر | قیف بوخنر معمولاً از سرامیک ساخته میشود و به وسیله آن مواد تحت خلاء بهتر و سریعتر صاف میشوند. |  |
قیف جداکننده | قیفی است که برای جدا کردن مایعات از آن استفاده میشود. برای استفاده از این قیف حتماً باید از پایه و گیره برای نگهداری آن استفاده کرد. |  |
| از این وسیله که در واقع یک قاشق بسیار ظریف و کوچک است برای برداشتن و جا به جا کردن مقادیر اندک مواد شیمیایی جامد استفاده میشود. به فارسی به نام های مختلفی مشهور است، مثلاً؛ کاردک و کفگیرک. پزشکان و داروسازان قدیمی ایرانی به چنین وسیلهای "مرهم کش" میگقتند. |  |
گیره | گیرهها برای نگه داری وسایل شیشهای مورد استفاده متعدد دارد و در شکل های مختلف ساخته میشود. |  |
هاون | هاون برای تبدیل جامدات به پودر استقاده میشود و معمولاً از جنس سرامیک است. اما از جنس شیشهای آن هم مورد استفاده قرار میگیرد. |  |
ترازوهایی که در آزمایشگاه استفاده میشوند متنوعند؛ از جمله ترازوهای یک کفهای، دو کفهای و ترازوهای دیجیتال |  | |
|
| |
| پیپت در واقع لوله بسیار نازکی است که برای برداشتن و جا به جا کردن مقادیر بسیار کم مایع به کار میرود و در انواع پلاستیکی و شیشهای ساخته میشود. |  |
میله همزن | میله همزن معمولاً از جنس شیشه است و برای هم زدن محلولها به کار میرود. |  |
| قطره چکان ها شامل یک لوله شیشه ای با نوک باریک و یک حباب پلاستیکی ارتجاعی است.. |  |
کاغذ صافی کاربرد فراوانی در آزمایشگاه های علمی دارد و به طور معمول برای جداسازی مواد جامد معلق در مایع به کار می رود و در شکل های متنوع ساخته میشود. |  | |
چوب پنبهها | چوب پنبهها را قبلاً از پوسته رویی نوعی از درخت بلوط به دست میآوردند. امروزه چوب پنبههای لاستیکی جایگزین آن ها شده است. مورد استفاده آن بستن محکم دهانه ظروف است. |  |
لوله آزمایش شاید پرکاربردترین وسیله آزمایشگاه شیمی باشد و برای مخلوط کردن، مشاهده، گرم و سرد کردن مواد و مقاصد بسیار دیگری مورد استفاده قرار میگیرد. بیشتر وقت ها نباید مستقیماً لوله آزمایش را با دست لمس کرد و باید برای حمل و نقل آن از "گیره لوله آزمایش" استفاده کرد. چون تهِ لوله آزمایش تخت نیست برای نگهداری آن از جا لولهای که وسیلهای است چوبی، پلاستیکی یا فلزی استفاده میشود. |  | |
| دماسنج برای اندازه گیری دقیق درجه حرارت استفاده میشود. | 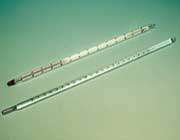 |
سه پایه | سه پایه تقریباً همیشه در هنگام گرم کردن مواد مورد استفاده قرار می گیرد. |  |
شیشه ساعت | شیشه ساعت معمولاً برای توزین یا جا به جا کردن جامدات استفاده میشود. |  |
| این وسیله به صورت لولههای پیچیده و درون هم ساخته شده و به طور خاص برای جدا کردن مایعاتی که در هم حل شدهاند به وسیله تبخیر و تقطیر به کار میرود. |  |
جواب پرسش های علوم تجربی پایه ی سوم بخش 1
جواب پرسش های علوم تجربی پایه ی سوم
مقایسه کنید
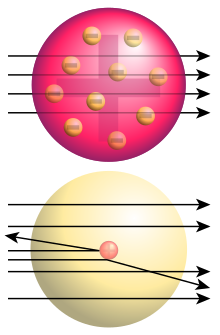
مدل اتمی تامسون و مدل اتمی رادفورد چه شباهت ها و چه
تفاوت هایی با یکدیگر دارند؟
شباهت ها :
1 – در هر دو
مدل اتم کروی شکل است.
2 – در هر دو مدل الکترون دارای بار منفی است
3 – هر
دو مدل اتم خنثی است و هر دو به یک اندازه بار مثبت و منفی دارند
تفاوت ها:
1 - در مدل تامسون، بار مثبت خمیر
کیک است. در مدل رادفورد، هسته در مرکز اتم و عمده جرم اتم را تشکیل می دهد.
2-
در مدل تامسون اتم تو پر و سفت است اما در مدل رادفورد بیشتر حجم اتم را فضای خالی
تشکیل می دهد.
3 – در مدل اتمی تامسون، الکترون ها مانند کشمش درون خمیری از بار
مثبت پخش شده اند. اما در مدل اتمی رادفورد، هسته ی اتم به وسیله ی الکترون ها
محاصره شده است.
مقایسه کنید .
مدل اتمی رادفورد با مدل اتمی بور چه شباهت ها و تفاوت
هایی با یکدیگر دارند؟ شباهت ها :
1- در هر دو، هسته در مرکز قرار
دارد
2 – در هر دو هسته دارای بار مثبت و الکترون دارای بار منفی است
3 – حجم
هسته ی اتم در مقایسه با حجم اتم بسیار کوچک است.
تفاوت ها :
1- د رمدل
اتمی رادفورد، هسته ی اتم به وسیله الکترون ها محاصره شده است، اما در مدل بور،
الکترون ها در مدارهایی به دور هسته می چرخند.
فکر
کنید :
مدل اتمی بور برای سه اتم مختلف در شکل زیر نشان داده شده
است.
1 – تعداد الکترون ها ، پروتون ها و فوترون ها را در هر اتم مشخص کنید.
|
تعداد نوترون |
تعداد پروتون |
تعداد الکترون |
نام اتم |
|
2 |
2 |
2 |
مدل1 |
|
4 |
3 |
3 |
مدل2 |
|
5 |
4 |
4 |
مدل3 |
2 – به مجموع تعداد پروتون های یک اتم، عدد اتمی آن می گویند
.عدد اتمی هر اتم را مشخص کنید
3 = تعداد پروتون = عدد اتمی (اتم
سمت چپ)
3 = تعداد پروتون = عدد (اتم وسط)
4 = تعداد پروتون = عدد اتمی (اتم
سمت راست)
3 – کدام اتم سنگین تر است؟ چرا؟
عدد جرم اتمی سمت راست بیشتر از اتم وسط و اتم وسط بیشتر از سمت چپ است پس اتم سمت راست سنگین تر از بقیه اتم هاست. زیرا عدد جرمی آن از بقیه بیشتر است.
مقایسه کنید : ص 11 مدل بور در سه اتم در شکل روبه رو نشان داده شده است:
1 – این سه اتم چه شباهتی با یکدیگر دارند؟عدد اتمی همه ی آنها با هم برابر است و تعداد الکترون های آنها نیز با
هم برابر است.
2 – این اتم ها چه تفاوتی با یکدیگر
دارند؟عدد جرمی این سه اتم با هم متفاوت است.
3 – هر یک از این اتم ها به چه عنصری تعلق
دارند؟هر سه این اتم ها، اتم هیدروژن هستند.
4- عدد اتمی و عدد جرمی هر یک از آن ها را معین
کنید.عدد اتمی آن ها برابر یک است. چون هر یک فقط یک پروتون دارند. عدد جرمی
اتم است سمت چپ یک ، اتم وسط دو اتم سمت راست برابر سه است.
فکر کنید :
برای اکسیژن سه ایزوتوپ در طبیعت یافت می شود.
جدول رو به رو این ایزوتوپ ها و فراوانی آنها را در طبیعت نشان می دهد.
1 –
عددهای نوشته شده در سمت چپ – بالا و پایین نماد شیمیایی ، چه معنایی
دارند؟
کدام ایزوتوپ اکسیژن از همه سبک تر است؟ چرا؟ایزوتوپ 16 از همه سبک تر است . چون عدد جرمی آن از بقیه کم تر است.
کدام ایزوتوپ اکسیژن در طبیعت بیشتر یافت می
شود؟ایزوتوپ 16 اکسیژن در طبیعت بیشتر یافت می شود.
محاسبه کنید :
فرمول شیمیایی برخی از ترکیب های شیمیایی
در زیر داده شد است:
الف – هر فرمول CH4 دو عنصر کربن و هیدروژن، در ترکیب ; C6H12O6 سه عنصر اکسیژن، در ترکیب HCL دو عنصر
هیدروژن و کلر و در ترکیب NO2
دو عنصر نیتروژن و اکسیژن بکار رفته است.
ب – فرمول وجود چند اتم از هر نوع عنصر
را در ساختار مولکول های آن ترکیب نشان می دهد؟
NO2; HCL; C6H12O6 ;
CH4
در ترکیب CH4 یک اتم کربن و 4 اتم هیدروژن، در ترکیب
C6H12O66 اتم کربن، 12 اتم نیتروژن،و 2 اتم
اکسیژن بکار رفته است.
فکر کنید
با دقت به شکل بخشی از شبکه ی بلوری نمک
خوراکی (شکل صفحه قبل) نگاه کنید. آیا می توانید نیروهای جاذبه ای را که باعث ایجاد
این شبکه ی بلوری شده است مشخص کنید؟
در شبکه ی بلوری نمک، یون سدیم دارای بار الکتریکی مثبت و یون کلرید دارای بار الکتریکی منفی است . نیروی جاذبه ی بین این دو یون مثبت و منفی باعث ایجاد یک شبکه بلوری در نمک خوراکی می شوند. (پیوند یونی)
سؤال از متن فصل 2 :
1 – دانشمندان برای نمایش مولکول
ها و ترکیب های شیمیایی از چه شیوه ای استفاده می کنند
آن ها شیوه ویژه ای را بکار می برند، به این صورت که نماد شیمیایی عنصرهای سازنده آن ها را کنار هم قرار می دهند. به این شیوه ی نمایش فرمول های شیمیایی می گویند.
2 – پیوند کووالانسی چیست؟
نوعی نیروی جاذبه است که اتم ها را در یک مولکول محکم کنار هم نگه می دارد.
3 – ترکیب مولکولی را تعریف کنید؟
از کنار هم قرارگرفتن شمار زیادی از یک نوع مولکول ماده ای بدست می آید که ترکیب مولکولی گفته می شود.
4 – چرا اتم به رغم داشتن الکترون و پروتون ذره ای خنثی است؟
زیرا تعداد الکترون ها و تعداد پروتون ها در هر اتم با یکدیگر برابر است.
5 – ترکیب های یونی چیست؟
مواد بسیاری وجود دارد که یون ذره های سازنده ی آن هستند. به این مواد ترکیب های یونی می گویند.
6 – در شبکه ی بلوری سدیم کلرید یون های سدیم و کلرید چگونه قرار گرفته اند؟
یون های سدیم و کلرید در شبکه بلوری سدیم کلرید بوسیله پیوندهای قوی یونی بطور بسیار منظمی در کنار هم قرارگرفته اند.
7 – محلول الکترولیت و غیرالکترولیت را تعریف کنید؟
ماده ای که محلول آن جریان برق را از خود عبور می دهد الکترولیت و ماده ای که محلول آن در آب جریان برق را از خود عبور نمی دهد، غیرالکترولیت نام دارد.
8 – مواد رنگی شناساگر چیست؟
رنگ های خوراکی بسیاری یافت می شوند که در اسیدها یک رنگ و در بازها رنگ دیگری دارند. به این مواد رنگی شناساگر می گویند.
اس ام اس های ویژه شهادت جواد الائمه (ع)
اس ام اس های ویژه شهادت جواد الائمه (ع)

سلام ما به رخ انور امام جواد
درود ما، به تن اطهر امام جواد
غریب بود و غریبانه جان سپرد و نبود
كسى به وادى غم، یاور امام جواد
sms اس ام اس شهادت امام جواد (ع) - اس ام اس شهادت امام محمد تقی (ع)-گرد آوری سایت تبیان زنجان sms
ای شیعه بزن ناله و فریاد امشب
از غربت آن غریب کن یاد امشب
مسموم شد از زهر، جواد بن رضا
در حجره ی در بسته ی بغداد امشب
sms اس ام اس شهادت امام جواد (ع) - اس ام اس شهادت امام محمد تقی (ع)-گرد آوری سایت تبیان زنجان sms
ابن الرضا به حجره غریبانه جان سپرد
او شمع جمع بود و چو پروانه جان سپرد
مسموم شد ز زهر جگر سوز اُمّ فضل
از روی شوق در ره جانانه جان سپرد
sms اس ام اس شهادت امام جواد (ع) - اس ام اس شهاد ت امام محمد تقی (ع)-گرد آوری سایت تبیان زنجان sms
خورشید سپهر عدل و داد است جواد
سر لوحه دفتر رشاد است جواد
در جود و سخا کسی به پایش نرسد
چون مظهر جود حق جواد است، جواد
sms اس ام اس شهادت امام جواد (ع) - اس ام اس شهادت امام محمد تقی (ع)-گرد آوری سایت تبیان زنجان sms
گشته عالم غرق ماتم در عزاى جوادالائمه
كرده زهرا ناله بر پا از براى جوادالائمه
یوسف زهرا به سن نوجوانى گشته مسموم
مى دهد جان در میان حجره ى در بسته مظلوم
sms اس ام اس شهادت امام جواد (ع) - اس ام اس شهادت امام محمد تقی (ع)-گرد آوری سایت تبیان زنجان sms
یاجواد الائمه! ای خورشید عشق
ای مولای جوان من
چه زود غروب کردی!
sms اس ام اس شهادت امام جواد (ع) - اس ام اس شهادت امام محمد تقی (ع)-گرد آوری سایت تبیان زنجان sms
گشته عالم، غرق ماتم
در عزای جواد الائمه
کرده زهرا ناله برپا
در عزای جواد الائمه
شد ز بیداد، شهر بغداد
کربلای جواد الائمه
sms اس ام اس شهادت امام جواد (ع) - اس ام اس شهادت امام محمد تقی (ع)-گرد آوری سایت تبیان زنجان sms
در میان حجره یا رب کیست غوغا میکند
شکوه زیر لب ز بی رحمی دنیا میکند
همسرش از فرط شادی و شعف کف میزند
زین عمل خود را به عالم خوار و رسوا میکند
sms اس ام اس شهادت امام جواد (ع) - اس ام اس شهادت امام محمد تقی (ع)-گرد آوری سایت تبیان زنجان sms
مظلوم تر از جواد، بغداد نداشت
آن مظهر داد، تاب بیداد نداشت
می خواست که فریاد کند تشنه لبم
از سوز عطش، طاقت فریاد نداشت
sms اس ام اس شهادت امام جواد (ع) - اس ام اس شهادت امام محمد تقی (ع)-گرد آوری سایت تبیان زنجان sms
ای شیعه بزن ناله و فریاد امشب از غربت آن غریب کن یاد امشب
مسموم شد از زهر، جواد بن رضا در حجره در بسته بغداد امشب
sms اس ام اس شهادت امام جواد (ع) - اس ام اس شهادت امام محمد تقی (ع)-گرد آوری سایت تبیان زنجان sms
می زنم امروز در کوی توَلاّیت قدم
تا بگیری دست این افتاده را فردا جواد
در گلستان محمد، نخل سرسبز رضا
میوه قلب علی، ریحانه زهرا جواد
sms اس ام اس شهادت امام جواد (ع) - اس ام اس شهاد امام محمد تقی (ع)-گرد آوری سایت تبیان زنجان sms
شهادت مظلومانه جوانترین شمع هدایت و نهمین بحر کرامت، تسلیت و تعزیت.
ای باب الحوائج، یا جواد الائمه! ای بهارِ نُهُم، تو را شهید کردند؛ در حالی که هنوز بیش از 25 گُل در باغِ عمرت شکوفا نشده بود.
ستاره جوان آسمان ولایت، با غروب سرخش، زمین را از داغ فراق پیر خواهد کرد.
سلام بر امام جواد(ع) که «جود» قطره ای بود در پیشانی بلندش و «علم» غنچه ای بود از گلستانِ وجودش و «حلم» گوهری بود از گنجینه فضایلش.
sms اس ام اس شهادت امام جواد (ع) - اس ام اس شهادت امام محمد تقی (ع)-گرد آوری سایت تبیان زنجان sms
شهادت غریبانه ی امام مسموم، جواد مظلوم(ع) بر شما تسلیت باد.
sms اس ام اس شهادت امام جواد (ع) - اس ام اس شهادت امام محمد تقی (ع)-گرد آوری سایت تبیان زنجان sms
ابن الرضا به حجره غریبانه جان سپرد او شمع جمع بود و چو پروانه جان سپرد
مسموم شد ز زهر جگر سوز اُمّ فضل از روی شوق در ره جانانه جان سپرد
نفرین بر آن محرم نامحرم
که زهر جفا را نه در جام تو که در کام ما ریخت
sms اس ام اس شهادت امام جواد (ع) - اس ام اس شهادت امام محمد تقی (ع)-گرد آوری سایت تبیان زنجان sms
شهادت مظهر جود و سخا و علم و معرفت، امام جواد(ع) تسلیت و تعزیت.
چون بخود نگریستم جز بی حیائی و بی شرمی در برابر ارباب خودم ندیدم
امشب دعایم کن تا دیگر باگناهانم دل فرزندت مهدی را نشکنم.
sms اس ام اس شهادت امام جواد (ع) - اس ام اس شهادت امام محمد تقی (ع)-گرد آوری سایت تبیان زنجان sms
غروب شفق گون نهمین آفتاب ولایت را تسلیت عرض میکنیم.
اي شيعه بزن ناله و فرياد امشب
از غربت آن غريب کن ياد امشب
مسموم شد از زهر، جواد بن رضا
در حجره ي در بسته ي بغداد امشب
sms اس ام اس شهادت امام جواد (ع) - اس ام اس شهادت امام محمد تقی (ع)-گرد آوری سایت تبیان زنجان sms
گشته عالم غرق ماتم در عزاى جوادالائمه
كرده زهرا ناله بر پا از براى جوادالائمه
يوسف زهرا به سن نوجوانى گشته مسموم
مى دهد جان در ميان حجره ى در بسته مظلوم
sms اس ام اس شهادت امام جواد (ع) - اس ام اس شهادت امام محمد تقی (ع)-گرد آوری سایت تبیان زنجان sms
می زنم امروز در کوی توَلاّیت قدم
تا بگیری دست این افتاده را فردا جواد
در گلستان محمد، نخل سرسبز رضا
میوه قلب علی، ریحانه زهرا جواد
مظلوم تر از جواد، بغداد نداشت
آن مظهر داد، تاب بیداد نداشت
می خواست که فریاد کند تشنه لبم
از سوز عطش، طاقت فریاد نداشت
گرد آوری توسط سایت تبیان زنجان
جواب سوالات بخش 1علوم دوم
جواب پرسش های سال دوم
فکر
کنید :3
در این متن به چند خاصیت فیزیکی گوگرد مشاهده شده است،با کشیدن خط زیر
هر خاصیت آن ها را مشخص کنید:«گوگرد جامد شکننده زردرنگی است که در دمای
119ºC ذوب می شود و در دمای 445ºC به جوش می آید. این نافلز جریان برق را از خود عبور نمی دهد
وارد آب حل نمی شود» .فکر
کنید : 4
آیا می توان تغییر فیزیکی را به تغییر در شیوه ی قرارگرفتن ذره های
سازنده یک ماده در کنار هم نسبت دارد؟
چون در تغییر فیزیکی خود ذرات هیچ تغیری نمی کند، بلکه جنبش و سرعت
آن ها نسبت به همدیگر تغییر می کند.
فکر کنید : 5
درهر مورد با بیان علت ،تغییرهای شرح داده شده را در
دو دسته ی فیزیکی و شیمیایی قرار دهید.
|
تغییر |
نوع |
دلیل |
|
ماست پس از مدتی ماندن در هوای گرم ترش
می شود |
شیمیایی |
تغییرذرات |
فکر کنید :6
1 – کدامیک از واژه های زیر برای بیان تغییر فیزیکی و
کدامیک برای معرفی تغییر شیمیایی بکار می روند.
خردکردن ، ساییدن ، ذوب شدن ، تبخیر شدن ، آسیاب کردن----> تغییر
فیزیکی
فاسد شدن ، زنگ زدن، سوزاندن ----> تغییر شیمیایی
2- برای شمع سه خاصیت فیزیکی و یک خاصیت شیمیایی مثال بزنید.6
خاصیت شیمیایی :به آسانی می سوزد خاصیت فیزیکی: جامد است – براثر گرما ذوب می شود – رنگ آن معمولاً سفید مایل به زرد است.
3- آیا می توانید تغییر شیمیایی را به تغییر در ساختار ذره های سازنده ی ماده نسبت داد ؟ با توجه به شکل زیر پا سخ خود را توضیح دهید6
بله،چون مولکول های سه اتمی گاز NO2 قهوه ای رنگ وقتی سرد می شود به مولکول های چهار اتمی N2O4 بی رنگ است تبدیل می شود پس چون ساختار مولکولی عوض
شده تغییر شیمیایی است.
فکر کنید :9
معلوم کنید که در هر مورد تغییر توضیح داده شده فیزیکی
یا شیمیایی است؟ آیا با اطلاعات داده شده می توان به این پرسش پاسخ داد؟
چرا؟
1-
یک مایع بی رنگ بر اثر گرم شدن به مرور ناپدید می شود.
فیزیکی : چون
تبخیر شده است
2-
2 – یک مایع سرد می شود و جامدی در ظرف ته نشین می شود.
فیزیکی
:چون وقتی سرد می شود مقداری از مواد محلول آن رسوب می کند
3-
3– یک ماده ی جامد آبی رنگ در آب حل می شود و آب را به رنگ آبی درمی
آورد.
فیزیکی : چون ماده در آب حل شده است.
4 – یک ماده جامد آبی رنگ می
شود و بوی تندی به مشام می رسد.
اطلاعات کامل نیست. زیرا ممکن است این مایع
وقتی به بخار تبدیل می شود بوی تند و تیز باشد یا ممکن است این مایع بر اثر گرما با
یک ماده دیگر واکنش شیمیایی انجام داده باشد و بوی تند و تیز ایجاد کند.
فکر
کنید 14
گرماده یا گرماگیر بودن هر یک از تغییرهای فیزیکی و شیمیایی زیر را
با آوردن دلیل مشخص کنید.
1 – تبخیر آب
2 – پختن غذا
3 – سوختن
نفت
1 – گرماگیر : زیرا برای تبدیل آب به بخار گرمای زیادی لازم است.
2 –
گرماگیر :برای اینکه غذا پخته شود به انرژی گرمایی نیاز دارد.
3 – گرماده :
زیرا وقتی نفت شروع به سوختن می کند مقداری زیادی گرما تولید می شود.
فکرکنید 19
با دقت به تصویر زیر نگاه کنید. واکنش دهنده ها و فرآورده های واکنش
نشان داده شده را مشخص کنید. اگر مولکول های موجود در دو طرف این واکنش را روی کفه
ی ترازو قرار دهید، کدام سمت سنگین تر خواهد بود؟ چرا؟
هر دوکفه با هم برابر هستند . چون طبق قانون پایستگی جرم در یک واکنش شیمیایی جرم واکنش دهنده ها برابر جرم فرآورده ها می باشد.
زندگينامه چادويك
جیمز چادویک
| سر جیمز چادویک Sir James Chadwick |
|
|---|---|
 |
|
| متولد | ۲۰ اکتبر، ۱۸۹۱ چشایر، انگلستان |
| مرگ | ۲۴ ژوئیه، ۱۹۷۴ کمبریج ٬ انگلستان |
| ملیت | |
| رشته فعالیت | فیزیک |
| محل کار | دانشگاه برلين دانشگاه لیورپول دانشگاه کمبریج |
| استاد راهنما | ارنست رادرفورد |
| دانشجویان دکتری وی | موریس گلدهابر ارنست سی.پولارد چارلز دروموند الیس |
| دلیل شهرت | کشف نوترون شرکت در پروژه منهتن |
| جوایز | جایزه نوبل در فیزیک (۱۹۳۵) |
سر جیمز چدویک (۲۰ اکتبر ۱۸۹۱ - ۲۴ ژوئیه ۱۹۷۴) (به انگلیسی: Sir James Chadwick)
فیزیکدان انگلیسی است. در سال ۱۹۳۲ نوترون را که رادرفورد در سال
۱۹۲۰ وجود آن را پیش بینی کرده بود، کشف کرد و به همین سبب، در سال ۱۹۳۵
جایزه نوبل فیزیک را دریافت کرد.

|
|
زندگینامه
چادویک در بولینگتن، چشیره از جان جوزف چادویک و آن مری نولز متولد شد. وی دوران تحصیلات ابتدایی خود را در بولینگتن گذراند و سپس به مدرسه گرامری منچستر رفت و پس از آن به دانشگاه منچستر و سپس به کمبریج رفت.
در سال ۱۹۱۳ چادویک رفت و با هانس گایگر در دانشکده فنی دانشگاه برلین مشغول به کار شد. او با ارنست رادرفورد نیز کار میکرد. در جنگ جهانی اوّل او در آلمان بود و در اردوگاهی خارج از برلین حضور داشت. درحالی که او در آنجا بود، برای خود آزادانه در آزمایشگاهی در استطبل به آزمایش می پرداخت. او به کمک چارلز اليس بر روی یونیزاسیون فسفر و همچنین برعکس واکنش شیمیایی کلر مونواکسید کربن مشغول به کار شد.
شغل
تحقیقات در کمبریج
در سال ۱۹۳۲، چدویک یک ذره ناشناخته در هسته اتم کشف کرد. این ذره به عنوان نوترون شناخته شد بدلیل عدم بار الکتریکی. کشف چادویک برای شکست اورانیوم ۲۳۵ بسیار مهم بود. برخلاف ذرات با بار مثبت آلفا، که توسط نیروهای الکتریکی موجود در هسته های دیگر دفع می شوند، نوترون ها به نیرویی برای غلبه بر کولن ها احتیاج ندارند و بنابراین می توانند در سنگین ترین عناصر نفوذ کنند و تقسیم شوند. برای این کشف به او مدال هیوز سلطنتی در سال ۱۹۳۲ و جایزه نوبل فیزیک در سال ۱۹۳۵ اهدا شد.
کشف چدویک امکان ایجاد عناصر سنگین تر از اورانیوم هایی را که در آزمایشگاه ها ساخته بودند را فراهم میکرد. کشف او الهام گرفته از انریکو فرمی، فیزیکدان ایتالیای و برنده جایزه نوبل است.
لیورپول
چادویک در سال ۱۹۳۵ استاد فیزیک در دانشگاه لیورپول شد. او در کمیته لوسی مود برای کار بر روی ماده منصوب شد. او به عنوان بخشی از مأموریت تیزارد در سال ۱۹۴۰ به همراه با آمریکایی ها و کانادایی ها برای تحقیقات هسته ای به شمال آمریکا رفت. وی در نوامبر سال ۱۹۴۰ به انگلستان بازگشت، او به این نتیجه رسید که هیچ چیز از این پژوهش تا بعد از جنگ ظهور نخواهد داشت. در دسامبر سال ۱۹۴۰ فرانتس سیمون، که توسط لوسی مود مأموریت داشت، گزارش داد که امکان جداکردن اورانیوم ۲۳۵ وجود دارد. گزارش سیمون شامل برآورد هزینه و مشخصات یک نیروگاه غنی سازی اورانیم بسیار بزرگ بود. جیمز چدویک بعدها نوشت که در آن زمان او متوجه شد که "یک بمب هسته ای نه تنها ممکن بلکه اجتناب ناپذیر نیز می باشد. من پس از آن قرص خواب می خوردم و این تنها راه چاره بود".
او در مدت کوتاهی پس از آن پروژه منهتن در ایالات متحده، به توسعه بمب های اتمی که در ناکازاکی و هیروشما افتادند پرداخت. چادویک در سال ۱۹۴۵ شوالیه شد.
در سال ۱۹۴۰، چادویک فرستاده شد به انجمن سلطنتی برای کار با دو دانشمند فرانسوی، هانس ون هالبان و لو کوارسکی که در کمبریج مشغول به کار بودند. او خواسته بوده است که مقالات آن ها در طول جنگ منتشر نشود. در سال ۲۰۰۷، این مقالات در جریان حسابرسی کشف شدند.
زندگينامه دموكريت
دموکریت
 |
||
| شناسنامه | ||
|---|---|---|
| نام کامل | دموکریت | |
| لقب | فیلسوف خندان | |
| تاریخ تولد | ۴۶۰ پیش از میلاد | |
| زادگاه | آبدرا، یونان | |
| تاریخ مرگ | ۳۷۰ پیش از میلاد | |
دِموکریت، دِموکریتوس یا ذیمقراطیس؛ از آخرین فیلسوفان یونانی پیش از سقراط بود. وی مهمترین شارح و بسطدهندهٔ افکار لئوکیپوس دربارهٔ اتمگرایی بود.
|
|
زندگی
دموکریت در آبدرا در تراس یونان متولد شد . سال تولد دموکریت را از این جملهٔ خود او که گفته «در هنگام کهنسالی آناکساگوراس، من جوان بودم.»؛ حدفاصل ۴۳۰ تا ۴۶۰ پیش از میلاد حدس زدهاند.
دموکریت برای تحصیل دانش سفرهای بسیاری در سرزمینهای شرقی و جنوبی کرد. مورخان احتمال میدهند که مدتی را در مصر به سر برده باشد، و مسلم است که به ایران نیز سفر کرده بودهاست .
وی سپس به آبدرا بازگشت و با افکار لئوکیپوس آشنا شد. زمانی که مکتب اتمگرایی شهرت یافت، به آتن سفر کرد. از پروتاگوراس معاصر او، در آتن با شوق بسیار استقبال شده بود؛ امّا دموکریت میگوید که«من به آتن رفتم و هیچ کس مرا نشناخت.»
در آتن مدتها به فلسفهٔ دموکریت توجّهی نشد. برنت مینویسد:«روشن نیست که افلاطون از دموکریت اطّلاعی داشته باشد، لیکن ارسطو او را خوب میشناخت.» دیوگنس لائرتیوس مینویسد که افلاطون چنان از دموکریت بدش میآمده که میخواسته همهٔ کتابهای او را بسوزاند .
روحیات
دموکریت در یونان باستان به عنوان «فیلسوف خندان» معروف بودهاست؛ زیرا بسیار بر ارزش شادمانی تاکید میکردهاست. دموکریت همیشه آمادهٔ استقبال از زندگی، هوادار مثبتاندیشی و بهرهگیری متعادل از لذائذ و دوری از ریاضت بود. از این رو، نظام اخلاقی اپیکوری در حقیقت همان اخلاق دموکریت است .
نظریات
دموکریت از بزرگترین فیلسوفان پیش از سقراط و ریاضیدانی پرتوش و توان بود. آثار بسیاری در زیستشناسی و موسیقی خلق کرد . اصل آثار دموکریت به دست ما نرسیدهاست. از او صرفآ نقل قولهایی به جا مانده، و نیز دیوژن تنها عنوان چند اثر از آثار او را یاد کردهاست: دربارهٔ آرامش روان، دربارهٔ طبیعت انسان، دوزخها، دربارهٔ سه نسل، علل زمینی هماهنگی و اعداد.
دموکریت نظامی فلسفی تأسیس کردهاست که تبیینی مادی از جهان طبیعی به حساب میآید و در این راه البته وی از معلمش لئوکیپوس متأثر است. اتمگرایی وی و پیروانش در بین مکاتب مادیمسلک، از تأثیر گذارترین و معروفترین مکاتب به شمار میرود. حتی ارسطو که منتقد جدی این مکتب فلسفی به شمار میرفت، دموکریتوس را به جهت تاملات ژرف در فلسفهٔ طبیعی تحسین و ستایش میکرد. وی اولین ارائه دهنده ی نظریه ی اتمی بودن جهان بوده است.
زندگينامه جوزف جان تامسون
جوزف جان تامسون
 |
|
| متولد | ۱۸ دسامبر ۱۸۵۶ |
| مرگ | منچستر ۳۰ اوت ۱۹۴۰ (۸۳ سال) |
| محل زندگی | کمبریج |
| ملیت | انگلیسی |
| رشته فعالیت | فیزیک |
| دلیل شهرت | کار بر روی خواص الکتریکی گازها |
| جوایز | جایزه نوبل فیزیک (۱۹۰۶) |
امضا |
|
جوزف جان تامسون فیزیکدان انگلیسی بود که در سال ۱۹۰۶ جایزه نوبل فیزیک را به خاطر کار بر روی خواص الکتریکی گازها به دست آورد.
وی همچنین پدر جرج پاجت تامسون بود که او هم در سال ۱۹۳۷ نوبل فیزیک را گرفت.
آزمایش تامسون (محاسبه نسبت بار به جرم الکترون)
در آزمایش تامسون از اثر میدان الکتریکی و میدان مغناطیسی استفاده شدهاست. دستگاهی که در این آزمایش مورد استفاده قرار گرفتهاست از قسمتهای زیر تشکیل شدهاست:
الف ) اطاق یونش که در حقیقت چشمه تهیه الکترون با سرعت معین میباشد بین کاتد و آند قرار گرفتهاست. در این قسمت در اثر تخلیه الکتریکی درون گاز ذرات کاتدی ( الکترون ) بوجود آمده بطرف قطب مثبت حرکت میکنند و با سرعت معینی از منفذی که روی آند تعبیه شده گذشته وارد قسمت دوم میشود. اگر بار الکتریکی کیو تحت تاثیر یک میدان الکتریکی بشدت ای قرار گیرد، نیروییکه از طرف میدان بر این بار الکتریکی وارد میشود برابر است با:
F= q.E
در آزمایش تامسون چون ذرات الکترون میباشند کیو مساوی منفی ای بنابراین:
F= -eE
از طرف دیگر چون شدت میدان ای در جهت پتانسیلهای نزولی یعنی از قطب مثبت بطرف قطب منفی است بنابراین جهت نیروی اف در خلاف جهت یعنی از قطب منفی بطرف قطب مثبت میباشد. اگرایکس فاصله بین آند و کاتد باشد کار نیروی اف در این فاصله برابر است با تغییرات انرژی جنبشی ذرات . از آنجاییکه کار انجام شده در این فاصله برابراست با مقدار بار ذره در اختلاف پتانسیل موجود بین کاتد وآند بنابراین خواهیم داشت
ev۰ =½m۰v۲
که در آن وی اختلاف پتانسیل بین کاتد و آند ای بار الکترون وی سرعت الکترون و m۰ جرم آن میباشد. بدیهی است اگر v۰ زیاد نباشد یعنی تا حدود هزار ولت رابطه فوق صدق میکند یعنی سرعت الکترون مقداری خواهد بود که میتوان از تغییرات جرم آن صرفنظ نمود . بنابراین سرعت الکترون در لحظه عبور از آند بسمت قسمت دوم دستگاه برابر است با:
v = √(۲e v۰/ m۰)
ب) قسمت دوم دستگاه که پرتو الکترونی با سرعت v وارد آن میشود شامل قسمتهای زیر است :
۱- یک خازن مسطح که از دو جوشن A وB تشکیل شدهاست اختلاف پتانسیل بین دو
جوشن حدود دویست تا سیصد ولت میباشد اگر پتانسیل بین دو جوشن را به v۱ و
فاصله دو جوشن را به d نمایش دهیم شدت میدان الکتریکی درون این خازن E =
v۱/d خواهد بود که در جهت پتانسیلهای نزولی است.
۲- یک آهنربا که در دو طرف حباب شیشهای قرار گرفته و در داخل دو جوشن
خازن: یک میدان مغناطیسی با شدت B ایجاد مینماید . آهنربا را طوری قرار
دهید که میدان مغناطیسی حاصل بر امتداد ox امتداد سرعت - و امتداد oy
امتداد میدان الکتریکی - عمود باشد.
پ) قسمت سوم دستگاه سطح درونی آن به روی سولفید آغشته شده که محل برخورد الکترونها را مشخص میکند.
وقتی الکترو از آند گذشت و وارد قسمت دوم شد اگر دو میدان الکتریکی و مغناطیسی تاثیر ننمایند نیرویی بر آنها وارد نمیشود لذا مسیر ذرات یعنی پرتو الکترونی مستقیم و در امتداد ox امتداد سرعت ) خواهد بود و در مرکز پرده حساس p یعنی نقطه p۰ اثر نورانی ظاهر میسازد.
اگر بین دو جوشن خازن اختلاف پتانسیلv۱ را برقرار کنیم شدت میدان الکتریکی دارای مقدار معین E خواهد بود و نیروی وارد از طرف چنین میدانی بر الکترون برابر است با FE = e E این نیرو در امتداد oy و در خلاف جهت میدان یعنی از بالا به پایین است.
میدان مغناطیسی B را طوری قرار میدهند که برسرعت v عمود باشد . الکترون
در عین حال در میدان مغناطیسی هم قرار میگیرد و نیرویی از طرف این میدان
بر آن وارد میشود که عمود بر سرعت و بر میدان خواهد بود . اگر این نیرو
را بصورت حاصلضرب برداری نشان دهیم برابر است با:
FM = q.(VXB) در اینجا q = e پس:
FM = q.(VXB)
و مقدار عددی این نیرو مساوی است با F = e v B زیرا میدان B بر سرعت v عمود است یعنی زاویه بین آنها ۹۰ درجه و سینوس آن برابر واحد است. اگر میدان B عمود بر صفحه تصویر و جهت آن بجلوی صفحه تصویر باشد امتداد و جهت نیروی FM در جهت oy یعنی در خلاف جهت FE خواهد بود. حال میدان مغناطیسی B را طوری تنظیم مینمایند کهFE = FM گردد و این دو نیرو همدیگر را خنثی نمایند. این حالت وقتی دست میدهد که اثر پرتو الکترونی روی پرده بی تغییر بماند پس در این صورت خواهیم داشت:
FM = FE
e.v.B = e E
v = E/ B
چون مقدار E و B معلوم است لذا از این رابطه مقدار سرعت الکترون در لحظه ورودی به خازن بدست میاید . حال که سرعت الکترون بدست آمد میدان مغناطیسی B را حذف میکنیم تا میدان الکتریکی به تنهای بر الکترون تاثیر نماید . از آنجاییکه در جهت ox نیرویی بر الکترون وارد نمیشود و فقط نیروی FE بطور دائم آنرا بطرف پایین میکشد لذا حرکت الکترون در داخل خازن مشابه حرکت پرتابی یک گلوله در امتداد افقی میباشد و چون سرعت الکترون را نسبتا کوچک در نظر میگیریم معادلات حرکت الکترون ( پرتو الکترونی ) در دو جهت ox و oy معادلات دیفرانسیل بوده و عبارت خواهد بود از
m۰(d۲x /dt۲)/span>=۰ در امتداox
m0d2y /dt2)=e. E در امتداoy
با توجه به اینکه مبدا حرکت را نقطه ورود به خازن فرض میکنیم اگر از معادلات فوق انتگرال بگیریم خواهیم داشت:
y=(۱/۲)(e.E)t۲/m۰
x=v.t
معادلات فوق نشان میدهد که مسیر حرکت یک سهمی است و مقدار انحراف پرتو الکترونی از امتداد اولیه (ox ) در نقطه خروج از خازن مقدار y در این لحظه خواهد بود . اگرطول خازن را به L نمایش دهیم x = L زمان لازم برای سیدن به انتهای خازن عبارت خواهد بود از t = L / v اگر این مقدار t را در معادله y قرار دهیم مقدار انحراف در لحظه خروج از خازن به دست میآید:
Y = ½ e( E/m۰) ( L/ v )۲
e/ m۰ = ( ۲y/ E ) ( v/ L )۲
که در آن v سرعت الکترون که قبلا بدست آمدهاست. L و E بترتیب طول خازن و شدت میدان الکتریکی که هر دو معلوم است پس اگر مقدار y را اندازه بگیریم بار ویژه یا e/m۰ محاسبه میشود.
پس از خروج الکترون از خازن دیگر هیچ نیرویی بر آن وارد نمیشود بنابراین از آن لحظه به بعد حرکت ذره مستقیم الخط خواهد بود و مسیر آن مماس بر سهمی در نقطه خروج از خازن است . اگر a فاصله پرده از خازن یعنی D P۰ باشد میتوانیم بنویسیم:
P۰P۱ = y + DP۰ tgθ
tgθعبارتست از ضریب زاویه مماس بر منحنی مسیر در نقطه خروج از خازن و بنابراین مقدار یست معلوم پس باید با اندازه گرفتن فاصله اثر روی پرده( P۰ P۱)به مقدار y رسید و در نتیجه میتوانیم e/ m۰ را محاسبه نماییم.
مقداری که در آزمایشات اولیه بدست آمده بود ۱۰۸×۷/۱ کولن بر گرم بود مقداریکه امروزه مورد قبول است و دقیقتر از مقدار قبلی است برابر ۱۰۸×۷۵۸۹/۱ کولن بر گرم است.
علاوه بر تامسون، میلیکان نیز از سال ۱۹۰۶ تا ۱۹۱۳ به مدت هفت سال با روشی متفاوت به اندازه گیری بار الکترون پرداخت.
برندگان جایزه ی نول فیزیک (۱۹۰۱ـ ۱۹۲۵)
ویلهلم کنراد رونتگن (۱۹۰۱) · هندریک لورنتز / پیتر زیمان (۱۹۰۲) · هانری بکرل / پیر کوری / ماری کوری (۱۹۰۳) · جان استرات (۱۹۰۴) · فیلیپ لنارت (۱۹۰۵) · جوزف جان تامسون (۱۹۰۶) · آلبرت آبراهام مایکلسون (۱۹۰۷) · گابریل لیپمن (۱۹۰۸) · گولیلمو مارکونی / کارل فردیناند برون (۱۹۰۹) · یوهان دیدریک وان در والس (۱۹۱۰) · ویلهلم وین (۱۹۱۱) · گوستاف دالن (۱۹۱۲) · هایک کامرلینگ اونس (۱۹۱۳) · ماکس فون لائو (۱۹۱۴) · ویلیام لورنس براگ / ویلیام هنری براگ (۱۹۱۵) · چارلز گلوور بارکلا (۱۹۱۷) · ماکس پلانک (۱۹۱۸) · یوهان اشتارک (۱۹۱۹) · شارل ادوارد گیوم (۱۹۲۰) · آلبرت اینشتین (۱۹۲۱) · نیلز بور (۱۹۲۲) · رابرت میلیکان (۱۹۲۳) · کارل مان گیورگ سیگبن (۱۹۲۴) · جیمز فرانک / گوستاو هرتز (۱۹۲۵)
زندگينامه رادرفورد
رنست رادرفورد
| ارنست رادرفورد Eenest Raderford |
|
|---|---|
 |
|
| متولد | ۳۰ اوت ۱۸۷۱ حومه برایتواتر شهر نلسون ساحل شمالی جزیره جنوبی |
| مرگ | ۱۹ اکتبر ۱۹۳۷ کمبریج در اثر یک فتق محتقن (گونهای تورم ناشی از انسداد اعضای درونی) |
| ملیت | |
| رشته فعالیت | شیمی |
| جوایز | |
ارنست رادرفورد ( Ernest Rutherford) فیزیکدانی هستهای اهل نیوزلند بود.
کودکی و نوجوانی
او در تاریخ ۳۰ اوت سال ۱۸۷۱ در حومه برایتواتر شهر نلسون واقع ساحل شمالی جزیره جنوبی نیوزلند به دنیا آمد . او چهارمین فرزند از دوازده فرزند جیمز و مارتا رادرفورد نیوزیلندیهای نسل اول بود که از کودکی از اسکاتلند به زلاند نو آورده شده بودند . خانواده رادرفورد در یک خانواده پر جمعیت دوازده بچهای بود که اعضای آن همه در انجام کارهای روزمره خانواده مشارکت میکردند اهل خانه همه افرادی جدی کلیسا رو، خوشحال و با فرهنگ بودند. علاقه مندی رادرفورد به علوم در مرحله زودی بروز کرد. او ده ساله بود که کتاب پرطرفداری بنام خواندنیهای اولیه در فیزیک تالیف معلمی بنام بالفور استوارت به دست آورد. کتاب استوارت مشابه کتابهای خود آموز فیزیک اموزی بود که در آنها نحوه به نمایش درآوردن اصول پایه فیزیک یا استفاده از اشیای ساده موجود در خانه مانند سکه، شمع، سنگ وزنه و وسایل آشپزخانه به خواننده یاد داده میشود . رادرفورد جوان سخت شیفته آن کتاب شده بود نخستین بورس از بورسهای تحصیلی متعدد زندگی خود را در سال ۱۸۸۷ که ۱۶ ساله بود به دست آورد.
تحصیل در دانشگاه
بورس تحصیلی دومی وی را قادر به ثبت نام در دانشکده کنتربوری شهر کرایستچرچ کرد که مؤسسهای بود که در سال پیش از تولد خود او بوجود آمده بود. وی رشتههای تحصیلی اصلی خود را فیزیک و ریاضیات انتخاب کرد که از بخت مساعد در هر دوی آنها معلمان خوبی هم داشت. رادرفورد در پایان دوره آموزشی سه ساله خود درجه کارشناسی ریاضی و فیزیک – ریاضی و (بطور کلی) علوم فیزیکی به پایان رسانید. نکته قابل ذکر در رابطه با زندگی خصوصی وی در ایام اقامت در کریستچرچ اینکه وی در آنجا با ماری نیوتن دختر صاحبخانه خود آشنا و پیبند عشق او شد . رادرفورد در پی انتشار دو مقاله مهم در باره فعالیت تشعشعی مواد در سال ۱۸۹۵ بر خلاف دوم شدن در گزینش جایزه مهمی به شکل یک بورس تحصیلی دریافت کرد مقررات اعطای جایزه حق انتخاب مؤسسه آموزشی را به خود برنده جایزه میداد که رادرفورد آزمایشگاه کاوندیش دانشگاه کمبریج به مدیریت جی .جی تامسون(صاحب نظر پیشتاز جهان در زمینه الکترومغناطیس) را برگزید در آن سال ویلهلم کنراد رونتگن فیزیکدان آلمانی موفق به کشف اشعه ایکس شد کشف مهم دیگری که منجر به شروع کار اصلی رادرفورد شد.
کارهای علمی
کشف هانری بکرل فرانسوی در سال ۱۸۹۸ بود . رادرفورد در سال ۱۸۹۵ به آزمایشگاه کاوندیش دانشگاه کمبریج آمد تا در آنجا تحت مدیریت جی.جی تامسون مشغول به کار شود تامسون که استاد فیزیک تجربی بود رادرفورد را فعالانه در آزمایشگاه به کار گرفت رادرفورد در اوایل کار تحقیقاتی خود با انجام آزمایشی که فکر آن از خود وی بود دو تابش رادیواکتیوی ناهمانند شناسایی کرد او پی برد که بخشی از تابش با برگهای به ضخامت یک پانصدم سانتی متر قابل ایستادن بود اما برای متوقف کردن بخش دیگر برگههای بس ضخیم تری لازم بود او اولین اشعهای را که تابشی با بار الکتریکی مثبت و يونيده کنندهای قوی بود و به سهولت در مواد جذب میشد اشعه آلفا نام داد. اشعه دوم را که تابشی بار الکتریکی منفی بود و تشعشع کمتری ایجاد میکرد اما قابلیت نفوذ آن در مواد زیاد بود اشعه بتا نامید . تابش نوع سومی که شبیه پرتوهای ایکس بود در سال ۱۹۰۰ بهوسیله پل اوریچ ویلارد(فیزیکدان فرانسوی) کشف شد این پرتو نافذترین تابش را داشت. طول موج آن بسیار کوتاه و بسامد آن فوق العاده زیاد بود تابش جدید، پرتو گاما نام گرفت. رادرفورد و همکارانش کشف کردند که فعالیت تشعشعی طبیعی مشهود در اورانیوم : فرآیند خروج ذره آلفا از هسته اتم اورانیوم بصورت یک هسته اتم هلیم و بر جای ماندن اتمی سبکتر از اتم اورانیوم در اورانیوم به ازاء هر خروج ذره آلفا از آن است از کشف آنها نتیجه گیری شد که رادیوم تنها عنصر از شرته عناصر حاصل از فعالیت تشعشعی اورانیوم است.
رادرفورد در سال ۱۹۰۳ به عضویت انجمن سلطنتی لندن در آمد و در سال ۱۹۰۴
نخستین کتاب خود به نام فعالیت تشعشعی را که امروزه از کتب کلاسیک نوشته
شده در آن زمینه شناخته میشود، منتشر کرد شهرت رو به افزون رادرفورد در
جوامع علمی سبب شد که از طرف دانشگاهها تصدی کرسیهای زیادی به وی
پیشنهاد شود او در سال ۱۹۰۷ به انگلستان بازگشت تا تصدی مقام مذکور را در
دانشگاه منچستر به عهده بگیرد رادرفورد در دانشگاه منچستر رهبر گروهی شد که
به سرعت دست به کار تدوین نظریههای تازه در باره ساختار اتم شد آن دوره
پر ثمرترین دوره زندگی دانشگاهی او بود رادرفورد به پاس کوششهای علمی خود
در دانشگاه منچستر نشانها و جوایز زیادی دریافت کرد که دریافت جایزه
نوبل سال ۱۹۰۷ در شیمی نقطه اوج آن بود این نشان افتخار را البته برای
کارهایی که در کانادا در زمینه فعالیت تشعشعی عناصر کرده بود به او دادند
بزرگترین دستاورد رادرفورد در دانشگاه منچستر کشف ساختار هسته
اتم بود پیش از رادرفورد اتم به گفته خود او یک موجود نازنین سخت و قرمز و
یا به حسب سلیقه خاکستری بود اما اینک یک منظومه شمسی بسیار ریز متشکل
از ذرات بی شمار بود که مظنون به نهفته داشتن اسرار ناگشوده متعدد دیگر در
سینه هم بود.
مرگ
رادرفورد در سال ۱۹۳۷ در اثر یک فتق محتقن(گونهای تورم ناشی از انسداد اعضای درونی) که به خاطر سقوط وی از درخت در هنگام هرس کردن آن اتفاق افتاد، در گذشت. او در آن هنگام ۶۶ ساله و هنوز سرزنده و قوی بود. سهم رادرفورد در شکل گیری درک کنونی ما از ماهیت ماده از هر کس دیگری بیشتر است. او اشکارا بزرگترین فیزیکدان آزمایشگری بود که تا آن زمان جهان به خود دیده بود. دهها انجمن علمی و دانشگاه به او عضویت و درجات دانشگاهی افتخاری داده اند و او را پدر انرژی هستهای نامیده اند./
یادبودها
-

تمبر یادبود ارنست رادرفورد - انتشار در سال ۱۹۷۱ - شوروی
-

تمبر یادبود ارنست رادرفورد - انتشار در سال ۲۰۰۱ - آنتیگوا و باربودا
-

تمبر یادبود ارنست رادرفورد - انتشار در سال ۲۰۰۱ - کنگو
-

تمبر یادبود ارنست رادرفورد - انتشار در سال ۲۰۰۶ - جیبوتی
- برندگان جایزه ی نول شیمی ( ۱۹۲۵-۱۹۰۱ )
۱۹۰۱: یاکوبوس هنریکوس وانتهوف (۱۹۰۱) • هرمان امیل فیشر (۱۹۰۲) • سوانت آرنیوس (۱۹۰۳) • ویلیام رمزی (۱۹۰۴) • آدولف فون بایر (۱۹۰۵) • هانری مواسان (۱۹۰۶) • ادوارد بوخنر (۱۹۰۷) • ارنست رادرفورد (۱۹۰۸) • ویلهلم اوستوالد (۱۹۰۹) • اوتو والاش (۱۹۱۰) • ماری کوری (۱۹۱۱) • ویکتور گرینیارد / پل ساباتیه (۱۹۱۲) • آلفرد ورنر (۱۹۱۳) • تئودور ویلیام ریچاردز (۱۹۱۴) • ریچارد ویلشتتر (۱۹۱۵) • فریتس هابر (۱۹۱۸) • والتر نرنست (۱۹۲۰) • فردریک سودی (۱۹۲۱) • فرانسیس ویلیام آستون (۱۹۲۲) • فریتز پرگل (۱۹۲۳) • ریچارد ژیگموندی (۱۹۲۵)
فصل 1علوم دوم – مواد در حال تغییر
فصل 1 – مواد در حال تغییر
نکات مهم درس
1 –به ویژگی های ماده خواص ماده گفته می شود.
2– خواص ماده بر دو نوع است : خواص فیزیکی و خواص شیمیایی .
3 – برخی از خواص فیزیکی ماده: رنگ، بو ، مزه ، اندازه ، نقطه جوش ، نقطه ذوب ، نقطه انجماد، حالت و...
4– تغییر فیزیکی : تغییری که در آن خواص فیزیکی ماده مانند : رنگ ، حالت ،شکل وغیره تغییر می کنند ولی ماده جدیدی به وجود نمی آید.
5– تغییر فیزیکی : تغییر در شیوه قرار گرفتن ذره های سازنده ماده در کنار هم .
6– تغییر شیمیایی : تغییری که طی آن از یک یا چند ماده ، ماده یا مواد شیمیایی تازه ای به وجود می آید.
7 – تغییر شیمیایی : تغییر در ساختار ذره های سازنده ماده
8– خواص شیمیایی : به مجموعه خواصی گفته می شود که تمایل یا عدم تمایل آن ماده برای شرکت در یک تغییر شیمیایی را بیان می کند.
9– برخی از خواص شیمیایی آب : نمی سوزد ( اشتعال ناپذیر ) ، در اثر تجزیه آن گازهای اکسیژن و هیدروژن به دست می آید ، زنگ زدن آهن را سریع تر می کند.
10 – آزمون شیمیایی : شناسایی مواد به کمک خواص شیمیایی آنها .
11 – اگر میخ آهنی را در محلول مس قرار دهیم ، مس قرمز رنگ روی میخ آهنی قرار می گیرد . 12 – اگر گاز کربن دی اکسید در آب آهک وارد شود ، آب آهک کدر می شود.
13 – اگر محلول ید به نشاسته اضافه شود رنگ آبی تیره یا بنفش ایجاد می کند.
14 – فرآورده : در هر تغییر شیمیایی مواد تازه ای به وجود می آید که به آنها فرآورده می گوییم . 15 – واکنش دهنده ( واکنش گر) : موادی که آغاز کننده تغییر شیمیایی هستند واکنش دهنده نامیده می شوند.
16 – سوختن نوعی تغییر شیمیایی است.
17– در معادله های نوشتاری همیشه واکنش دهنده ها قبل از فلش و فرآورده ها بعد از فلش نوشته می شوند.
18 – نظر لاووازیه در مورد سوختن درست بود او می گفت : اکسیژن موجود در هوا با مواد شیمیایی واکنش می دهد و ضمن ترکیب شدن با آنها باعث سوخته شدن آنها می شود.
19 – زنگ زدن : آهن در برابر هوا به آهستگی با اکسیژن واکنش می دهد و دچار تغییر شیمیایی می شود به این تغییر شیمیایی زنگ زدن می گویند.
سایت های برتر شیمی
معرفي سايتهاي برتر شيمي
شيميدان هاي نامي اسلام
شيميدان هاي نامي اسلام
آغاز كيمياگري اسلامي با اسامي مرداني همراه است كه احتمالا خود كيمياگر نبودهاند، اما با گذشت زمان و فرارسيدن قرن دهم ميلادي ، كيمياگران شهيري از ميان آنان برخاستند كه علاوه بر تفكراتشان ، نوشتارهاي كاملا جديد و نويني خلق كردند.امام جعفر صادق عليه السلام (148 ـ 82 هـ . ق. / 770 ـ 705 م(
محضر پر فيض حضرت امام صادق (ع) ، مجمع جويندگان علوم بود. با دانش پژوهي كه به محفل آن حضرت راه مييافت از خرمن لايزال دانش او بهره مند ميشد. در علم كيميا ايشان نخستين كسي بودند كه عقيده به عناصر چهارگانه (عناصر اربعه) آب ، آتش ، خاك و باد را متزلزل كردند. از فرمودههاي ايشان است كه : «من تعجب ميكنم مردي چون ارسطو چگونه متوجه نشده بود كه خاك يك عنصر نيست. بلكه عنصرهاي متعددي در آن وجود دارد.» ايشان هزار سال پيش از پرسينلي ، لاووازيه و ... دريافته بود كه در آب چيزي هست كه ميسوزد (كه امروزه آن را هيدروژن مينامند).
از امام صادق (ع) ، رسالهاي در علم كيميا تحت عنوان «رسالة في علم الصناعة و الحجر المكرم» باقيمانده كه دكتر «روسكا» آن را به زبان آلماني ترجمه و در سال 1924 آن را تحت عنوان «جعفر صادق امام شيعيان ، كيمياگر عربي» در «هايدبرگ» به چاپ رسانده است. به عنوان مثال و براي آشنايي با نظرات حضرت صادق (ع) در شيمي ، خلاصهاي از بررسي دكتر «محمد يحيي هاشمي» را در ذيل درج ميكنيم:
از شرحي كه امام صادق (ع) براي اكسيد ميدهد، چنين معلوم ميشود كه اكسيد جسمي بوده كه از آن براي رفع ناخالصي در فلزات استفاده شده است. ايشان تهيه اكسيد اصغر (اكسيد زرد) را از خود و آهن و خاكستر به كمك حرارت و با وسايل آزمايشگاهي آن دوره ، مفصلا شرح داده و نتيجه عمل را كه جسمي زرد رنگ است، اكسيد زرد نام نهادهاند. اين شرح كاملا با فروسيانيد پتاسيم كه جسمي است زرد رنگ به فرمول Fe(CN)6] K4] منطبق است و ... . نتيجه عمل بعد از طي مراحلي ايجاد و تهيه طلاي خالص است. امروزه نيز از همين خاصيت سيانور مضاعف طلا و پتاس براي آبكاري با طلا استفاده ميشود.
جدول تناوبی
http://www.ptable.com/?lang=fa
خواص انجير
انجير وخواص آن
انجیر تازه منبع غنی بتاکاروتن و ویتامین ث است. این دو آنتی اکسیدان در پیشگیری از ابتلا به سرطان نقش مهمی را ایفا میکنند.

مطالعات نشان می دهد که انجیر حاوی مقادیر زیادی آهن و ویتامین C است؛ مخلوطی از این دو ماده مغذی، آن را به یک میوه فوقالعاده برای کمخونها مخصوصا افراد مبتلا به کمخونی فقرآهن تبدیل کرده است.
انجیر در درمان و بهبود یبوست، سوءهاضمه، سرفه، برونشیت و آسم کاربرد دارد، مصرف این میوه پس از ابتلا به بیماری، به افزایش وزن نیز کمک میکند.
هر دو حالت انجیره خشک و تازه مفید و مغذی است با وجود این که انجیر خشک در تمام طول سال در دسترس است، اما خیلیها معتقدند جای طعم خوش و منحصربه فرد انجیر تازه را نمیگیرد.
انجیر در طب سنتی
انجیر از نظر طب قدیم ایران، گرم و تر است، تعرق بدن و ادرار را زیاد میکند، حرارت بدن را کاهش میدهد و میوه ای چاقکننده است، جوشانده انجیر خشک درمان کننده التهاب مجاری دستگاه تنفسی، کلیه، ذاتالریه، سرخک، مخملک و آبله است همچنین جوشانده غلیظ انجیر خشک برای رفع سرماخوردگی بسیار مفید است و غرغره کردن آن گلودرد را برطرف میکند.
انجیر برای درمان سوءهاضمه مفید است، مخلوط شیر بز و انجیر سیاه یکی از داروهای بسیار موثر برای درمان آرتروز و درد مفاصل است این مخلوط سموم مختلف را از بدن خارج کرده و درد را از بین میبرد همچنین این میوه برای افرادی که قند خونشان پایین میآید و یک دفعه احساس ضعف میکنند مناسب است، زیرا قند آن به سرعت در روده کوچک جذب میشود.
انجیر برای بهبود مشکلاتی نظیر تب، گوش درد و ورم چرکی کاربرد دارد و برای کمک به کبد هم عالی است، موجب از بین رفتن بوی بد دهان نیز میشود ، مخلوط انجیر با عسل در تسکین زخم معده بسیار مفید است ، همچنین منبع خوبی از کلسیم و هم منبع خوبی از پتاسیم است. کلسیم موجب افزایش تراکم استخوان و پتاسیم، دفع کلسیم از طریق ادرار را کاهش میدهد؛ از این رو انجیر یکی از بهترین میوهها برای افزایش تراکم استخوان است.
از طرفی انجیر به خاطر داشتن قند فراوان باعث فعالیت سلولها و تولید انرژی زیاد در بدن نیز میشود، همان چیزی که معمولا کمخونها از آن شکایت دارند.
انجیر منبع خوبی از پتاسیم است و پتاسیم نیز عنصری است که به کنترل فشار خون کمک میکند. کمبود پتاسیم به خصوص زمانی که با افزایش مصرف سدیم همراه باشد، میتواند منجر به فشار خون بالا شود، به علت داشتن پتاسیم، درجه قلیایی بدن را بالا برده و در دفع اوره و چربی خون بسیار موثر است.
این میوه منبع بسیار خوبی از فیبر غذایی است. شاید بدانید که مواد غذایی حاوی فیبر نقش موثر و مفیدی در مدیریت و کنترل وزن ایفا میکنند. فیبر، گرسنگی را به تاخیر میاندازد و از این رو در رژیم های کاهش وزن جایگاه ویژهای دارد البته به آن شرط که در خوردن آن و سایر مواد غذایی نیز از حد تعادل خارج نشویم.
درمان یبوست
پزشکان در گذشته یبوست را امالامراض یا مادر بیماریها نامیدهاند، پس اهمیت پیشگیری و درمان آن مشخص است، بهترین داروی آزمایش شده و خوش طعم در این زمینه انجیر است. فیبر موجود در انجیر به عملکرد سالم روده کمک میکند، این عمل مانع بروز یبوست میشود. برای رفع یبوست ۱۰ عدد انجیر خشک را به خوبی شسته و در ظرف آبی بخیسانید و صبح ناشتا بخورید.
انجیر برای کودکان ضعیف
متخصصان تغذیه می گویند؛ انجیر میوهای مقوی و شیرین است که منبع خوبی از پتاسیم، منیزیم، کلسیم، فسفر و ویتامینهای A، B و C است. انجیر سرشار از پتاسیم و تامین کننده سلامت کودکان ضعیف است و برای بیاشتهایی مفید است.
۴۰ گرم انجیر تازه یا یک چهارم لیوان انجیر معادل یک واحد میوه است و ۱٫۵ عدد انجیر خشک معادل یک واحد میوه یا ۱۵ گرم کربوهیدرات است.
انجیر، فیبر غذایی بالایی دارد که هر واحد آن ۲۰ درصد نیاز روزانه را تامین میکند و بیش از سایر میوهها املاح دارد.
در هر ۴۰ گرم انجیر تازه ۲۴۴ میلیگرم پتاسیم (۷ درصد نیاز روزانه)، ۵۳ میلیگرم کلسیم و ۱٫۲ میلیگرم آهن (۶ درصد نیاز روزانه) وجود دارد.
هر ۲۲۴ گرم انجیر، ۷۹میلیگرم کلسیم دارد. تحقیقات نشان داده است که کلسیم در انجیر به همان اندازهی کلسیم موجود در شیر است.
انجیر برای سلامت موها
وجود گوگرد در انجیر باعث ازدیاد مو شده و از ریزش آن جلوگیری کرده و شوره سر را درمان میکند.
انجیر برای تقویت حافظه
خوردن انجیر خشک همراه پسته، بادام و گردو موجب تقویت حافظه و قدرت تعقل و تفکر شده و گنجاندن آن در برنامه غذایی زنان باردار باعث تقویت حافظه جنین میشود.
انجیر و سلامت دهان و دندان
انجیر باعث سفید شدن دندانها و جرمگیری آنها میشود و در ورم لثه موجب تسکین درد و رفع التهاب می شود.
انجیر و سلامت ریهها
این میوه التهابات تنفسی مانند ذاتالریه، آسم و تنگی نفس را بهبود میبخشد. از جوشاندن انجیر در شیر، شربتی به دست میآید که نرمکننده سینه و معده بوده و غرغره آن، گلو را نرم میکند.
شربت انجیر مسکن گلو و سرفه بوده و ملین سبکی به شمار میرود، لذا برای تهیه آن ۵ تا ۱۰ عدد انجیر خشک را در مقداری آب بجوشانید تا آن که به حالت شربت درآید.
برای درمان ناراحتیهای سینه حدود ۲۰ گرم از خرما، عناب و انجیر خشک را با هم مخلوط کرده و آسیاب کرده، سپس این پودر را با یک لیتر آب جوشانده تا حجم آن به نصف برسد. از این جوشانده میتوان به مقدار ۳ فنجان در روز مصرف کرد.
برای برطرف کردن سیاه سرفه، برونشیت و ذاتالریه از قهوه انجیر استفاده کنید و برای درست کردن این قهوه انجیر را ابتدا بو داده و سپس آن را آسیاب کنید تا به صورت پودر درآید.
اثرات موضعی انجیر
شیره انجیر، میخچه، زگیل و آثار جلدی را از بین میبرد. همچنین اگر یک انجیر خشک را پخته و سپس به دو نیم تقسیم کنید و روی کورک یا دمل قرار دهید، بزودی آن را رسانده و رفع التهاب میکند.
انجیر و شیردهی
سوپ انجیر بسیار مقوی است و برای افزایش شیر در زنان شیرده مفید است. برای تهیه سوپ، انجیر نارس را با گوشت بپزید. جوشانده انجیر خشک در شیر برای درمان آنژین، ورم لثه و ورم مخاط دهان نیز موثر است.
انجیر مانع رشد میکربهای مضر در مواد غذایی میشود ، مطالعات جدید نشان میدهد که انجیر و عصاره آن ممکن است اثر بازدارنده بر رشد و بقای میکربهای مضر مواد غذایی داشته باشد. اخیرا گروهی از محققان در کارولینای شمالی، اثر ضد میکربی عصاره انجیر را در کاهش بار میکربی انواع میکربهای آلوده کننده مواد غذایی اشریشیاکلی و سالمونلا مورد بررسی قرار دادهاند. این یافته میتواند در صنعت مواد غذایی مورد توجه قرار گیرد.
شرایط انتخاب و نگهداری
پوست انجیر تازه بسیار نرم است از این رو یکی از میوههایی است که به راحتی و در حمل و نقل و هنگام نگهداری خراب میشود، پس مهم است دقت کنیم که خیلی هم زودتر از مصرف این میوه را خریداری نکنیم، حداکثر یک یا ۲ روز زودتر، همچنین برای بهره بردن از فواید آن سعی کنید انجیرهای تازه و رسیده را انتخاب کنید.
بوی انجیر نیز راه خوبی برای درک تازگی آن خواهد بود. انجیر نباید بوی ترشیدگی بدهد.
زیاده روی ممنوع
انجیر برای مبتلایان به بیماری قند مضر است، زیاده روی در خوردن انجیر، برای معده و چشم، زیانآور است و خنثی کننده زیان آن، کرفس است، انجیر به علت دارا بودن دانههای ریز، باعث تقویت معده و روده میشود، ولی برای کبدهای ضعیف زیانآور است، زیاده روی در مصرف آن موجب چاقی میشود.
در ضمن مصرف بیش از حد انجیر ممکن است موجب بروز اسهال شود که باید دقت کرد، همچنین انجیر خشک حاوی مقدار زیادی قند است که میتواند برای دندانها مشکلاتی را ایجاد کند. پس تعادل در مصرف نیز نباید فراموش شود.
ترکيبات و فوايد خرمالو براي سلامتي
ترکيبات و فوايد خرمالو براي سلامتي
خرمالو که ميوهاي بسيار شيرين و خوشمزه است، سرشار از موادمغذي سالمي مثل
ويتامين، موادمعدني و آنتياکسيدان مي باشد. اين ميوه بومي کشور چين است.
ساليان پيش به کشور ژاپن برده شد و بعدها در اواسط دهه نوزده وارد امريکا
گشت.
خرمالو درختي چندتنه يا تک ريشه است که تا 25 فوت رشد ميکند. اين درخت در مناطقي که زمستانها و تابستانهاي معتدل دارد بهتر رشد ميکند.
درختهاي خرمالو دو نوع اصلي دارند: آنهايي که ميوه گس بار ميدهند تازمانيکه رسيده شده و آنهايي که ميوه غيرگس بار ميدهند. نوع گس آن که معمولاً در ژاپن کشت ميشود و هاکيا (Hachia) نام دارد، سرشار از تانين است و براي خوردن بايد تا رسيده شدن کامل و نرم شدن آن صبر شود. از طرف ديگر، خرمالوي غيرگس تانين کمتري دارد و مثل سيب به صورت سفت هم قابل خوردن است. با اعمال دياکسيد کربن يا الکل به اين ميوه ميتوان گسي آن را از بين برد.
طي هر فصلي که درختان خرمالو بار ميدهند، ميوههاي زيادي با شکلهاي مختلف و کشتهاي مختلف توليد ميشوند. سايز آنها هم متفاوت است و از خيلي کوچک تا درشت در تغيير است. رنگ اين ميوه نيز از زرد-نارنجي کمرنگ تا نارنجي بسيار تيره در نوسان است. کل اين ميوه قابل خوردن است مگر دانهها و کاسهگل.
فوايد خرمالو
• اين ميوه بسيار کمکالري و کمچربي است (هر 100 گرم 70 کالري دارد) و منبع بسيار خوبي از فيبر ميباشد.
• خرمالو موادمغذي آنتياکسيدانه زيادي مثل کاتچين و گالوکاتچين و همچنين ترکيبي آنتيتومور به نام اسيد بتولينيک در خود دارد. کاتچينها ضدعفونيکننده، ضدالتهاب، و ضدخونريزي هستند.
• خرمالوي تازه حاوي ترکيبات آنتياکسيدانه ويتامين A، بتاکاروتين، ليکوپن، لوتئين، زآکسانتين و کريپتوکسانتين ميباشد. اينها در کنار هم محافظاني در عليه راديکالهاي آزاد به شما ميروند که موجب پيري و بيماريهاي مختلف ميشوند.
• زآکسانتين، که يک کاروتينوئيد مهم است، جذب ماکولا شبکيه چشم ميشود که تصور ميشود خواص آنتياکسيدانه و عملکردهاي فيلترکننده نور دارد؛ درنتيجه به جلوگيري از بيماري ماکولا مرتبط با پيري چشم در افراد سالخورده کمک ميکند.
• اين ميوه منبع بسيار خوبي از ويتامين C ميباشد که يک آنتياکسيدان قوي ديگر است. مصرف مداوم موادغذايي سرشار از اين ويتامين به بدن براي مقاومت دربرابر عوامل عفوني و راديکالهاي آزاد کمک ميکند.
• اين ميوه همچنين انواع مختلف ويتامينهاي B را نيز در خود دارد مثل اسيد فوليک، پيريدوکسين (ويتامين B6)، تيامين و از اين قبيل. اين ويتامينها جزء عوامل دخيل در عملکردهاي آنزيمي متابوليک بدن ميباشد.
• خرمالوي تازه همچنين حاوي مقدار سالمي از موادمعدني مثل پتاسيم، منگنز، مس و فسفر ميباشد. منگنز عامل مشترک براي آنزيم سوپراکسيد ديسموتاز ميباشد که از بين برنده راديکال آزاد بسيار قوي است. مس عامل مشترک با بسياري آنزيمهاي حياتي از قبيل سيتوکروم سياکسيداز و سوپراکسيد ديسموتاز است (ساير موادمعدني بعنوان عامل همکار با اين آنزيم منگنز و زينک هستند). مس همچنين براي توليد گلوبولهاي قرمز خون نيز لازم است.
براي تحليل بيشتر موادمغذي اين جدول را مطالعه کنيد:
|
|
ارزش غذايي به ازاي هر 100 گرم خرمالوي تازه |
|
| ماده | ارزش غذايي | درصد RDA |
| انرژي | 70 کيلوکالري | 3.5 % |
| کربوهيدرات | 18.59 گرم | 14 % |
| پروتئين | 0.58 گرم | 1 % |
| چربي کل | 0.19 گرم | 1 % |
| کلسترول | 0 گرم | 0 % |
| فيبر | 3.6 گرم | 9.5 % |
| ويتامين ها |
|
|
| کولين | 7.6 ميلي گرم | 1.5 % |
| فولات | 8 ميکرو گرم | 2 % |
| نياسين | 0.100 ميلي گرم | 1 % |
| پيريدوکسين | 0.100 ميلي گرم | 7.5 % |
| ريبوفلاوين | 0.020 ميلي گرم | 1.5 % |
| تيامين | 0.030 ميلي گرم | 2.5 % |
| ويتامين C | 7.5 ميلي گرم | 12.5 % |
| ويتامين A | 81 IU | 3 % |
| ويتامين E | 0.73 ميلي گرم | 5 % |
| ويتامين K | 2.6 ميکرو گرم | 2 % |
| الکتروليت ها |
|
|
| سديم | 1 ميلي گرم | 0 % |
| پتاسيم | 161 ميلي گرم | 2.5 % |
| مواد معدني |
|
|
| کلسيم | 8 ميلي گرم | 0.8 % |
| مس | 0.113 ميلي گرم | 12.5 % |
| آهن | 0.15 ميلي گرم | 2 % |
| منيزيم | 9 ميلي گرم | 2 % |
| منگنز | 0.355 ميلي گرم | 15 % |
| فسفر | 17 ميلي گرم | 4.5 % |
| زينک | 0.11 ميلي گرم | 1 % |
| مواد مغذي گياهي |
|
|
| کاروتين-α | 0 ميکرو گرم | --- |
| کاروتين-β | 253 ميکرو گرم | --- |
| کريپتو-زانسين-β | 1447 ميکرو گرم | --- |
| لوتئين-زآکسانتين | 834 ميکرو گرم | --- |
| ليکوپن | 159 ميکرو گرم | --- |
خرمالو گس زماني برداشت ميشوند که سفت اما کاملاً رسيده باشند. خرمالوهاي غيرگس زماني آماده برداشت مي شوند که کاملاً رنگ گرفته و کمي نرم شدهاند. خرمالوهاي گس در دماي اتاق نيز ميتوانند رسيدهتر شوند.
موقع خريد خرمالو تازه که رنگ نارنجي روشن دارد و اثر لک يا برش روي آن ديده نميشود را انتخاب کنيد. خرمالوهاي خشک نيز در سوپرمارکتها موجود است و تقريباً شبيه به زردآلو خشک ميماند.
خرمالوهاي گس رسيده و سفت را ميتوان ماهها در يخچال نگهداري کرد. خرمالوهاي غيرگس زمان ماندگار کوتاهتري دارند و فقط چند روز در دماي اتاق قابل نگهداري هستند.
خرمالو به صورت تازه، خشک يا پخته قابل مصرف هستند. خرمالو تازه و کال را
ميتوان به چهار قسمت تقسيم کرد يا مثل سيب به طور کامل خورد.
در زير چند نکته براي سرو خرمالو به شما پيشنهاد ميکنيم:
• خرمالوي خشک را ميتوان در شيريني، کيک، پودينگ، سالاد و سيريال استفاده کرد.
• پودينگ خرمالو دسري بسيار پرطرفدار است که در آن از خرمالو تازه استفاده ميشود.
• خرمالو خشک نيز به صورت تنقلات يا در دسرها قابل استفاده ميباشد.
مطالبي درباره ي جدول تناوبي
| لاوازيه - فرانسوی(L.Lavoisier1743-94)
اولين كسی بود كه عناصر را براساس خواص شيميايی به دو دسته فلز ونافلز تقسيم كرد فلز را عنصری مي دانست كه در تركيب با اكسيژن ،توليد بازكند. نافلز را عنصری مي دانست كه با اكسيژن توليد اسيد كند |
| برزليوس - سوئدی(Berzelius1779-1848)
مانند لاوازيه عناصر را به دودسته فلز ونافلز تقسيم كرد وی معتقد بود كه: فلز عنصری است كه تمايل به تشكيل يون مثبت دارد . نافلز عنصری است كه تمايل به تشكيل يون منفي دارد |
| دوبراينر- آلماني(J.W.Dobreiner1780-1840)
نمونه های سه تايي برای عناصر درنظر گرفت . در اين طبقه بندی سه تايي , جرم اتمي عنصر مياني برابربا ميانگين تقريبي جرم اتمي دوعنصر طرفين است |
| دوشان كورتوآ- فرانسویVDe Chan Courtois1862
او برای تنظيم جدول خود ، استوانه ای را در نظر گرفت و محيط آن را به 16 قسمت كرد. خطی شيب دار با شيب 45 درجه از محل تقاطع يال اول با قاعده رسم كرد تايال ها رايكی پس از ديگری قطع كند . عناصر در محل تقاطع يالها با خط شيب دار قرار دارند . اين طبقه بندی معروف به پيچ تلوريك شد. |
| ويليام اودلينگ - انگليسی(WilliamOdling1864)
جدولی در5 ستون و 7 سطر تنظيم كرد . (به ترتيب صعود جرم اتمی ). عناصر واقع در هر سطر خواص شيميايی مشابهی داشتند |
| نيولاندز- انگليسیVNewlands1865
جدولی در 8 ستون و 7 سطر تنظيم كرد . او دريافته بود چنانچه عناصر به ترتيب صعودجرم اتمی كنار هم قرار داده شوند ،پس از هر 7 عنصر ، خواص تكرار می شود . يعنی خواص عنصر هشتم با عنصر اول , مشابهت دارد . با توجه و علاقه او به موسيقی در مقايسه با 8 نت (اوكتاو ) موسيقی او كشف خود را قانون اكتاو ها ناميد . |
| لوتارمير (J.Lothar Meyer1870)
ثابت كرد كه بعضي از خواص عناصر ، تابعی از جرم اتمی آنها است. نمودار تغييرات حجم اتمی بر حسب جرم اتمی آنهارا رسم كرد. |
| مندليف (D.I.Mendeleev1869)
با بررسی خواص عناصر و تركيبات آنها از جمله تركيبات دوتايی هيدروژن دار و اكسيژن دار دريافت كه خواص شيميايی عناصر مانند خواص فيزيكی آنها نسبت به جرم اتمی روندی تناوبی دارد . مندلیف با بررسی خواص عناصر و تركيبات آنها از جمله تركيبات دوتايی هيدروژن دار و اكسيژن داردريافت كه خواص شيميايی عناصر مانند خواص فيزيكی آنها نسبت به جرم اتمی روندی تناوبی دارد . جدول مندليف برپايه ويژگی های فيزيكی و شيميايی 63 عنصر استوار بود. مندليف يافته های خود رابرای عناصر ، مقايسه و طبقه بندی كرد و متوجه يك نظام درتكرار تناوبی خواص شد. اصول مندليف: هر گاه عنصر ها بر اساس افزايش جرم اتمي مرتب شوند ، خواص فيزيكی و شيميايیآن ها به طور تناوبی تكرار می شود. عنصر هايی كه در يك گروه قرار می گيرند ، بايد خواص نسبتا مشابهی داشته باشند. خواص عناصر كشف نشده را پيشگويی كرد. در برخی از مواقع اصل تشابه خواص را براصل افزايش جرم اتمی برتری می دادمثل : آرگون و پتاسيم - كبالت و نيكل برخی خانه های جدول خود را خالی گذاشت تا بتواند عنصر هايی با خواص مشابه رايك گروه قرار دهد. جدول تناوبی جدید با پيشرفت تحقيقات علمی , سرانجام با كشف اشعه X عناصر مختلف و بررسی دقيق طيف آنها ,عدد اتمی توسط موزلی كشف شد و معلوم شد كه اگر به جای جرم اتمی از عدد اتمی استفاده شود , ايراد های وارد شده بر جدول مندليف بر طرف می شود. نکات جدول تناوبی جدول تناوبی امروزی بر پايه ی قانون تناوبی استوار است. قانون تناوبی عناصر : هر گاه عنصر ها بر اساس افزايش عدداتمی مرتب شوند ، خواص فيزيكی و شيميايی آنها به طور تناوبی تكرار می شود. عدد اتمی هر عنصر مقدار معين وثابتی بوده ،( بر خلاف جرم اتمی) عددی صحيح است. گروه های جدول تناوبی را از راست به چپ به ترتيب از 1 تا 18 شماره گذاری می كنند. بسياری از خواص فيزيكی و شيميايی يك عنصر به تعداد الكترون های لايه ظرفيت اتم آن عنصر بستگی دارد. عناصر يك گروه تعداد الكترونهای لايه ظرفيت برابری دارند. عناصر جدول را به سه دسته فلز و نافلز و شبه فلز تقسيم می كنيم. |
16 مادهی غذایــی پاییــزی برای لاغــری
16 مادهی غذایــی
پاییــزی برای لاغــری
مسلماً هیچ مادهی غذایی
معجزه آسایی وجود ندارد
که با خوردن آنها یک شبه
لاغر شوید. اما اگر با
رسیدن فصل پاییز قصد
دارید چند کیلو کم کنید
میتوانید روی مواد غذایی
معرفی شده در این مطلب
حساب کنید.
لاغر شدن نیاز به تغییر
سبک زندگی، تغذیهی درست
و ورزش منظم دارد. اما
اگر با رسیدن فصل پاییز
قصد دارید چند کیلو کم
کنید میتوانید روی مواد
غذایی معرفی شده در این
مطلب حساب کنید. این مواد
غذایی کم کالریاند، به
شما احساس سیری طولانی
مدتی میدهند و در
سوزاندن کالریها به شما
کمک میکنند. توصیه میکنیم
با مصرف زیاد این مواد
غذایی به استقبال فصل
سرما و خوش اندامتر شدن
بروید. با ما همراه باشید.
سیر
به گزارش Daily Mail UK،
دانشمندان به خاصیت جدیدی
از سیر پی بردهاند. این
مادهی غذایی پرطرفدار
دارای خاصیتی است که از
اضافه وزن جلوگیری کرده و
حتی باعث لاغری میشود.
محققان آزمایشهایی روی
موشهای آزمایشگاهی انجام
دادند و مشاهده کردند موشهایی
که سیر مصرف میکنند حتی
با داشتن یک رژیم غذایی
شیرین نیز کمتر در معرض
چاقی و اضافه وزن قرار میگیرند.
یعنی اگر نمیتوانید جلوی
شیرینی خوردن خود را
بگیرید پا به پای آن سیر
هم مصرف کنید.
چغندر
چغندر یکی از سبزیجاتی
است که حاوی بیشترین
میزان قند است اما با این
حال کالری کمی دارد یعنی
حدود 50 کالری در هر
فنجان. اگر چغندر را با
سبزیجات دیگر میل کنید یک
مادهی غذایی لاغری بی
نظیر مصرف کردهاید.
بروکلی
بروکلیِ عزیز سرشار از
فیبر و مواد مغذی است که
هر دو برای سلامت و خوش
اندامی شما لازم و ضروری
است. علاوه بر این بروکلی
کم کالری است و به شما
احساس سیری طولانی مدتی
میدهد. زمانی که گرسنه
نباشید هم که خودتان بهتر
میدانید، کمتر به سراغ
پرخوری میروید.
زغال اخته
زغال اخته کم کالری و
حاوی گلوسیدهای کمی است
اما در عین حال سرشار از
فیبر است. نصف فنجان زغال
اخته حاوی 25 کالری است.
شاید به دلیل طعم ترش آن
کمتر تمایل به مصرف این
مادهی غذایی داشته باشید.
توصیه میکنیم زغال اخته
را به عنوان مثال به
سالادهایتان اضافه کنید و
از خواص آن بهره ببرید.
کرفس
افرادی که قصد لاغری
دارند کرفس زیادی میخورند
به خاطر این که یک مادهی
غذایی کم کالری است. دو
شاخه کرفس حاوی حدود 95
درصد آب است. کرفس سرشار
از فیبر است و همین
فیبرها یک مادهی مغذی
سالم ساخته است.
قارچ
قارچ اشتها برانگیز و
مغذی و در عین حال کم
کالری است. هر نصف فنجان
قارچ حاوی 10 کالری است.
این مادهی غذایی
پرطرفدار کمابیش فاقد
چربی است و منبع خوب
فیبرها، پتاسیم، سلنیوم،
ریبوفلاوین، تیامین،
اسیدفولیک، ویتامین B6 و
زینک (روی) است.
باید بدانید دو هفته مصرف
منظم قارچ خام باعث کاهش
وزن خواهد شد. در واقع
بیشتر ستارههای سینما
برای لاغری رژیم غذایی
حاوی قارچ خام را دنبال
میکنند.
کلم
کلم سرشار از فیبر بوده و
کم کالری است. هر فنجان
کلم برگ خرد شده حاوی 20
کالری است. کلمها جزو
سبزیجات بسیار مغذی محسوب
میشوند و برای افرادی که
قصد لاغری دارند یک مادهی
غذایی فوقالعاده است.
کدو تنبل
کدو تنبل یک مادهی غذایی
لاغر کنندهی بسیار موثر
است. این کدوی گرد و
قلمبه کم کالری بوده و در
عین حال سرشار از فیبر،
ویتامینها و مواد معدنی
است. باید بدانید که کدو
تنبل حاوی میزان زیادی
بتاکاروتن است.
توت فرنگی پاییزی
اگر هوس میوهی شیرین
کردهاید توت فرنگی
پاییزی را انتخاب کنید.
این میوهی قرمز، کم
کالری و سرشار از مواد
مغذی است. برای همین در
عین حالی که یک میوهی
شیرین میل کردهاید گامی
هم در جهت خوش اندامی خود
برداشتهاید.
کلم بوک چوی
کلم بوک چوی یک کلم چینی
است. هر فنجان کلم پخته
حاوی 20 کالری است.
این کلم سرشار از آب و
انواع فیبرها میباشد و
باعث ایجاد احساس سیری
طولانی مدت میشود. به
این ترتیب شما را در مسیر
لاغری قرار میدهد.
کاهو
اگر به لاغری و زیبایی
اندام خود اهمیت میدهید
کاهو را دریابید. کاهو کم
کالری است و احساس سیری
طولانی مدتی ایجاد میکند
به خاطر این که سرشار از
فیبر است. بسیاری از
ستاره های هالیوودی برای
لاغری از این مادهی
غذایی استفاده میکنند.
بلال
احتمالاً خواندن این آیتم
شما را هم یاد شیر بلال و
بوی زغال انداخت. باید
بدانید هر بلال متوسط
حاوی 83 کالری است. این
مادهی غذایی خوشمزه
سرشار از پتاسیم و تیامین
است و حاوی میزان قابل
توجهی فیبر و پروتئین میباشد.
بلال جلوی اشتهای زیاد را
میگیرد و سیری طولانی
مدتی ایجاد میکند.
هویج فرنگی
هویج فرنگی یک ماده غذایی
نشاستهای مغذی و کم
کالری و سرشار از فیبر
است. در هر نصف فنجان از
این هویج 60 کالری وجود
دارد. هویج فرنگی شما را
سیر میکند و جلوی پرخوری
را میگیرد.
فلفل تند
فلفل تند طعم تندی به
غذاها میدهد و در عین
حال کم کالری است. اگر میخواهید
متابولیسم یا همان سوخت و
ساز بدنتان را تحریک کنید
به سراغ فلفل تند بروید.
این مادهی غذایی
پرطرفدار به سوزاندن چربیها
کمک کرده و احساس سیری
طولانی مدتی هم ایجاد میکند.
گلابی
گلابی سرشار از فیبر است
که به کنترل دستگاه گوارش
کمک میکند. این مادهی
غذایی حاوی فیبری به نام
پکتین است که احساس سیری
طولانی مدتی ایجاد میکند
و جلوی پرخوری را میگیرد.
سیب
یک عدد سیب یک میان وعدهی
ایده آل محسوب میشود.
سیب خوش طعم و کم کالری
است. یک عدد سیب 140 گرمی
به زحمت 90 کالری دارد.
اشعار و پیامکهای ولادت امام رضا(ع)
اشعار و پیامکهای ولادت امام رضا(ع)
میلاد شمس الشموس، خسرو اقلیم طوس ،شاه انیس النفوس تهنیت باد -=-=-=-=-=-=-=-=-=-=- این زمزمه در عرش برین است امشب مژده به محمد و علی و زهرا -=-=-=-=-=-=-=-=-=-=- موج کرم به اوج تلاطم رسیده است داوود عاشقی به ترنم رسیده است -=-=-=-=-=-=-=-=-=-=- بر روی رضا شمس امامت صلوات در شام ولادتش که شادند همه -=-=-=-=-=-=-=-=-=-=- مژده ای اهل رضا، روی رضا پیدا شد ضعفا روی به گلزار ولایت آرید -=-=-=-=-=-=-=-=-=-=- یا علی موسی الرضا دردم دوا کن جان معصومه عزیز شهر قم -=-=-=-=-=-=-=-=-=-=- چون گل، به بیابان خراسان آمد ای کاش منم خاک خراسان بودم -=-=-=-=-=-=-=-=-=-=- دلم مجنون روی ماه تو گشت ضمانم کن ،به این وصل و نه هجران -=-=-=-=-=-=-=-=-=-=- با یاد رضا، رضای دلدار بجوی ای دل بجز از ضامن آهو درمان؛ -=-=-=-=-=-=-=-=-=-=- ذیقعده شد و بهار ایران آمد در روز یکم کریمه آل رسول -=-=-=-=-=-=-=-=-=-=- در دامن نجمه آیت نور آمد تا زنده کند سنت احمد، طفلی -=-=-=-=-=-=-=-=-=-=- ای ملایک کبوتر حرمت نه خراسان فقط،که ملک خداست -=-=-=-=-=-=-=-=-=-=- در ولا فصل الخطاب نامۀ ایمان رضاست در «رضی الله عنهم ورضو» عنوان رضاست
پیدایش نور شمس دین است امشب
میلاد امام هشتمین است امشب
ناز و نماز و شوق و تبسم رسیده است
کعبه کجاست قبله هشتم رسیده است
بر شافع ما روز قیامت صلوات
بفرست بر این روح کرامت صلوات
جلوه حسن الهی به فضا پیدا شد
که گل روی معین الضعفا پیدا شد
امشب از روی کرم حاجت روا کن
تو نظر بر شیعیان مصطفی کن
با لطف و کرم، شاه غریبان آمد
آن لحظه که چون فصل بهاران آمد
مرا سویت بخوان ای ساقی هشت
بسان آهوی بیچاره ی دشت
با راه رضا، طریق دلدار بپوی
از کس مطلب دوا ز ادیار مجوی
در مشهد و قم دو گنج پنهان آمد
در یازدهم شاه خراسان آمد
نور متجلای شب طور آمد
با منطق و علم و حکم و منشور آمد
چشم آدم به گندم کرمت
عالمی زیر سایۀ علمت
آنکه بر فضلش گواهی میدهد قرآن رضاست
چون«رضا» بر«صبر»هم دارد شرف، سلطان رضاست
ای فضل تو بیکــران رضاجان
ای جنت جــاودان رضــاجان
ای جلـــوۀ لامکان رضــاجان
مرضیّ و رضیِّ جـان رضاجان
عالم ز پیات روان رضــاجان
ای آمـــده زآسمان رضـاجان
جانِ دل و جان بمان رضاجان
ای جـان همه جهان رضـاجان
جان تو و شیعیان رضاجان
ای سلسلـــۀ الـذهب کـلامت
از هـــر چـــه بلنــدتر مقــامت
گــــوینـد فرشتــگان سلامت
ای واجـب عینــــی احتــرامت
خــورشید، کبــوتری به بامت
آه ای به رضــــا رسیــده نامت
از خــالقِ مهــربان، رضـا جان
ای جان همــــه جهان رضاجان
جان تو و شیعیان رضاجان
ای مقصــدِ شوق کـــــاروانها
دلهـــا ز پـــی تــوأند و جانــها
جــان و دل پیـــرهـا، جـوانها
مشهـــور تـــویی در آسمـــانها
وصف کـــرمِ تــو بـر زبانــها
مشهور کــــرم، تـو در جهانها
عالم بــه تو میهمان رضــاجان
ای جـــان همه جهان رضـاجان
جان تو و شیعیان رضاجان
جــان در حـــرمِ تـو پر گرفته
دل رفتــه ز جــان خبــر گرفتـه
پــروانـــه شده، شرر گـــرفته
تا خــاکِ تــو را بـه بــر گـرفته
عالــــم سخنت بـــه زر گرفته
گــر خصم، رهــی دگر گرفتـه
ماییـــم و تو همچنان رضاجان
ای جان همــه جهان رضـاجان
جان تو و شیعیان رضاجان
مقبــول خـــدا تویی رضاجان
خورشیــد هدی تویی رضاجان
شاه دو سرا تویـــی رضــاجان
هم عينِ «رضا» تويي رضــاجان
هم حسن قضـا تویی رضاجان
جان و دل مــا تویی رضــاجـان
عالم همه تن، توجان رضاجان
ای جان همـــه جهان رضاجـان
جان تو و شیعیان رضاجان
ای گل ز تو رنگ و بو گرفته
چـــون غنچه ز غیـر، رو گرفته
مــه در حـرمت وضـو گـرفته
مهـــر از رخت آبـــرو گــرفته
اشک است و ره گـــلو گرفته
بغضـــم ره گفتــــگو گـــرفته
خودحرف دلم بخوان رضاجان
ای جـــان همه جهان رضاجان
جان تو و شیعیان رضاجان
عــرش است مقام بارگـــاهت
ای چشم ملک به روي مــاهت
من عــابر کـــوچــۀ نگــاهت
قـــربان نگـــــاه خیـــرخواهت
اي هر چه كه هست در پناهت
من سر نکشم، به خــاک راهت
زین قبـــله و آستان، رضاجان
ای جان همـــه جهان رضاجـان
جان تو و شیعیان رضاجان
هر چنـــد که غرقــۀ گنـــاهم
شرمنــــدۀ نــامـــــۀ سیـــــاهم
آهـــویم و گمشدهست راهـم
خود نیست جز این حرم پناهــم
من جز تو ولیِّ خود نخواهم
ای قافـــلههــای اشک و آهــم
دنبــال تـــو مهــــربان رضاجان
ای جان همه جهان رضاجان
جان تـو و شیعیان رضاجان
توحیــــد به شرط توست کامل
ای آینــــۀ فــرشتـــهْ حــامل
ای عـــرشیِ پاکِ نـــورْ محـمل
محمود تـــو را همــه خصائل
خــــورشيدي و چشمـــة فضائل
مهمــان توییـم و جمـله سائل
قــربان تـــو میـــزبان، رضـاجان
ای جان همـه جهان رضاجان
جان تو و شیعیان رضاجان
ای وارث مسنــــدِ معـــــــارف
تا کیست بـه رفعت تو عارف
ای حسن تــــو مجمــع اللطائف
دل در حرمت همیشه عاکف
جـــان گشتــه به گنبد تو طائف
ای بر تــو به جمـــلۀ مـواقف
پیـــوسته درودمـــان رضــاجان
ای جان همه جهان رضاجـان
جان تو و شیعیان رضاجان
هـــر چنــد کــــه میکنم تأمّل
دل هجر تو کی کند تحمّـل؟
جــــز بــــر تو کجا برم توسّل؟
تمثيــــل رضـــايي و تـوكّل
ای خاک قـــدوم تـــو همه گل
نام تـــو بر آسمـــان زده پل
از نور، چــــو نردبــان، رضاجان
ای جان همه جهان رضاجان
جان تو و شیعیان رضـاجان
تا سایـــۀ تـــوست بـــر سر مـــا
چــون نور خـداست، رهبر ما
حبّ است و ولاست سنــــگر ما
کشتـی نجـــات و لنــــگر ما
دوری ز تــــو نیست بـــاور مــــا
طوبـــایــی و سایــه گستر ما
ای گلشن گلفشـــــان رضـــاجان
ای جان همه جهان رضاجان
جـــان تو وشیعیان رضاجان
«ای نـــــور بتــــاب جان مـارا
ده جلـــوه همه روان مارا
پــــر نــــور کـــن آسمان مارا
افــــزون بنمـــا توان مـارا
پــر بــــار نمــــا نهـــان مـــارا
تضمین بنمـــا جنــان مارا
ای خسروانس وجــان رضاجان
ای جان همه جهان رضاجان
جــان تو و شیعیان رضاجان
در عیـــد ولادت تــــو ای شاه
هستیم پنــاهنده به درگاه
مــــارا نبـــود به جـز درت راه
ای هـادی خلقها الـی الله
هستـــی تـوزآنچه گـویم آگاه
درشام ظلال من توئی ماه
خواهیـــم زتو امــان رضا جان
ای جان همه جهان رضاجان
جان تو و شیعیان رضاجان
عیــد است وهمـه در آرزوئیم
زین یمن همه شکفته روئیم
با نـــام تو گرم گفتــــگوئیـم
ما جز رۀ تو رهی نپوئیــم
چیــزی به جــز از ولا نجوئیم
مادر پی کسب آبروئیــم
مارا سوی خود بخوان رضا جان
ای جان همه جهان رضاجان
جان تو و شیعیان رضاجان
مسكينم اي كريم به دربارت آمدم
خارم ولي به ساحت گلزارت آمدم
همسايه توام من و در سايه ي توام
بار دگر به ساحت گلزارت آمدم
اي جلوه وجلال خداوند ذوالجلال
درجلوه گاه روشن ايثارت آمدم
خورشيد بي غروب كرامت توئي ومن
چون ذره اي به جانب انوار آمدم
مثل غبار راه در اين آستان قدس
اكنون به پايبوسي زوارت آمدم
هر دلشكسته اي ز تو خشنود مي شود
من هم به پاس ديدن رفتارت آمدم
يك ذره از عنايت تو كم نمي شود
تنها به شوق رأفت بسيارت آمدم
گر مي كني قبول مرا بر غلاميت
همچون غلام بر سر بازارت آمدم
با اشك و ناله گفت«وفائي» در اين حريم
آزاده ام چنين كه گرفتارت آمدم
شاعر:وفائی
...مسافر
دارم ميرم كه به همه سر بزنم
بگم منو حلال كنيد همين روزا مسافرم
بگم مي خوام برم سفر يه جاي خوب و دلربا
قسمت من شده برم به حرم امام رضا
يه كوله بار حاجت دارم يه چمدون پر از دعا
يه كيسه گندم مي برم اونجا برا كبوترا
مادر بزرگم اومد و قاليچه اي رو دست خود گرفته بود
دونه دونه رج رجشو به عشق آقا بافته بود
مي گفت ننه ازت مي خوام براي من دعا كني
وقتي كه اونجا رسيدي نذر منو ادا كني
قاليچه منو ببر به حرم امام رضا
دلم ميخواد بندازنش به زير پاي زائرا
راهي ميشم سوي سفر دوباره مثل هميشه
دعاي خير مادرم بدرقه راهم ميشه
با بوسه مهربونش بهم ميگه كه دخترم
سپردمت من به خدا تو رو خدا سلامم و ببر برا امام رضا
آب ميريزه پشت سرم دوباره ميخونه دعا
به زير لب آروم ميگه فالله خير حافظا
همسفر من تو مسير يه پير زن بود با صفا
خودش ميگفت تا حالا نرفته اون امام رضا
خوشحال و پر شور شعف وراج و پر سر و صدا
از قديما قصه ميگفت.جوونياش.زمون شاه
نزديكاي اذان صبح راننده زد بلند صدا
رسيديم. اينجا مشهده .پياده شن مسافرا
هر كي پياده ميشد و گنبد آقا رو ميديد
اشك تو چشاش حلقه ميزد به سوي آقا ميدويد
صداي زيباي اذان پخش ميشد از نقاره ها
عطر خوش نماز صبح پيچيده بود توي فضا
رو به روي گنبدش دوباره زانو ميزنم
براي وارد شدنم كسب اجازه مي كنم
من غريبم آقا جون غريب نوازي ميكني؟
تو غريب الغربايي منو راضي ميكني؟
تو كريمي آقا جون مهربونيت زبون زده
به همين اميد دلم اين راه دور و اومده
دست خالي هيچ كسي از در خونت نميره
گداي در به درت تو رو شاهد مي گيره
تو دل خسته من يه عالمه درد و غمه
هر چي كه يا رضا ميگم بازم كمه
اونقده يا رضا ميگم تا كه منو نگاه كني
گره كار منو با يه اشاره وا كني
دل تنهام و ببين بي قرار و بي شكيب
توي صحنت ميشينم ميخونم امن يجيب
رو به روي گنبدت نماز حاجت ميخونم
تا جوابمو ندي من در خونت مي مونم
ای امام مهربانم یا رضا
نام تو ورد زبانم یا رضا
حاجت خود را نخواهم از کسی
تا تو هستی میزبانم یا رضا
دست خالی بار سنگین رو سیاه
میهمانم میهمانم یا رضا
پای خدّامت به روی دیده ام
درد زوارت به جانم یا رضا
تو کریم ابن کریم ابن کریم
من گدای آستانم یا رضا
در کنار آستانت بی نیاز
از بهشت جاودانم یا رضا
راز خود ناگفته می دانم توئی
واقف از درد نهانم یا رضا
گر چه از هر خار راهه خارتر
زائر این بوستانم یا رضا
تو بهار باغ دلهائی و من
کمتر از برگ خزانم یا رضا
چون گدایان سمج از دست تو
حاجتم را می ستانم یا رضا
دست خالی رفتن از دربار تو
نیست هرگز این گمانم یا رضا
جان زهرا گر چه قابل نیستم
لطف خود را ده نشانم یا رضا
خاک پای میثم دار شما
میثم این خاندان یا رضا
حاج غلامرضا سازگار
 این وبلاگ جهت استفاده ی دانش آموزان وهمکاران محترم بخصوص دانش آموزان مدرسه ي شاهدامام محمدباقر(ع)مي باشد.
این وبلاگ جهت استفاده ی دانش آموزان وهمکاران محترم بخصوص دانش آموزان مدرسه ي شاهدامام محمدباقر(ع)مي باشد.